Notes personnelles dans une perspective de soins palliatifs "oncologiques" Par : Brizard, André, MD
Chapitres 2 à 50 Chapitres 51 à 100 Chapitres 101 à 150 Chapitres 151 à 203 Tous les chapitres de 1 à 203
2 - Contenu
Le matériel éducatif qui suit: "Ces personnes qui ont mal" - "Notes personnelles dans une perspective de soins palliatifs "oncologiques"" propose un contenu de connaissances sur le domaine de la douleur. Il se divise en six (6) manuels dédiés à des thèmes complémentaires.

1. Les différents types de douleur selon les bases pathophysiologiques et psychoaffectives.
( Douleur physique et douleur "totale" ou "globale" )3 - Avant-propos
Ce projet de matériel éducatif découle tout particulièrement de l'intégration d'expériences cliniques répétées vécues au fil des années depuis 1985 en soins palliatifs auprès de personnes en phase palliative et terminale de cancer et qui éprouvaient des douleurs et de la souffrance.
Il ne prétend pas appartenir aux savants traités sur la douleur. Il découle d'une structuration d'observations, de lectures, de déductions et de notes personnelles accumulées au cours des années. Il ne se veut pas exhaustif non plus. Ce projet se veut uniquement un effort personnel pour faire oeuvre de vulgarisation face à des notions qui nous paraissent le plus souvent d'une extrême complexité. Il s'adresse particulièrement aux intervenants de première ligne du monde de la médecine, des soins infirmiers et de la pharmacie.
Aucun effort n'a été épargné pour offrir des connaissances conformes à la littérature dans le domaine de la santé. Le contenu de ces différents documents sera toujours perfectible surtout en tenant compte de l'avancement des connaissances dans les domaines à la fois fondamentaux et cliniques de la douleur. Le défi de vouloir faire oeuvre de vulgarisation nécessite de toujours tenter de conserver un certain équilibre entre le fondamental et l'utile et c'est ce qui a été tenté tout au long de ces écrits.
4 - Droits d'auteur
Ce matériel éducatif peut être copié et reproduit, en partie ou en totalité, mais ne peut, à aucun moment, être modifié sans la permission écrite de l'auteur qui peut être obtenue à l'adresse suivante:
André Brizard, m.d.
Centre Hospitalier Universitaire de Sherbrooke - Fleurimont (CHUS-F)
3001, 12e avenue Nord
Sherbrooke J1H 5N4
Québec, Canada5 - Remerciements
Qu'il me soit permis à travers ce premier manuel d'exprimer des remerciements à tous ceux et celles qui ont rendu sa réalisation possible.
Les premiers remerciements s'adressent au Dr. Alexandre Madernas (B.Sc., M.Sc., MD) pour la révision en profondeur du manuel dans sa version 1998.
Je voudrais aussi remercier les différents collaborateurs qui ont accepté de revoir le contenu de ce manuel de même que ses différents aspects et qui ont proposé une précieuse gamme de commentaires et de suggestions très appréciés. Ma reconnaissance s'adresse aussi à Michèle Brizard, mon épouse et consoeur de travail, qui m'a soutenu tout au long de ce projet.
6 - Mise à jour
Des modalités de "MISE A JOUR" seront disponibles dans la mesure où vous cochez la case "Me contacter par courriel pour des nouveautés sur le site".
7 - Commentaires - Questions - Suggestions
Tout élément suivant:
QUESTIONS
COMMENTAIRES
SUGGESTIONS
CORRECTIONSrelatifs à l'utilisation de ce matériel éducatif et pouvant mener à
* une meilleure utilisation et à une meilleure compréhension de son contenu
* un ou des ajouts non élaborés dans le présent document
peuvent être adressés à:André Brizard M.D.
Centre Hospitalier Universitaire de Sherbrooke - Fleurimont
3001, 12e avenue Nord
Sherbrooke, J1H 5N4
Québec, Canadaou à l'adresse E-mail suivante: andre.brizard@USherbrooke.ca
8 - Page titre
MANUEL 1
Les différents types de douleur
Les composantes physiques et les bases pathophysiologiques
Les composantes non-physiques c.-a.-d. affectives ou émotionnelles et les bases psycho-socio-spirituelles
9 - Généralités
Ce premier manuel a pour but de fournir certaines connaissances de base permettant d'intervenir dans le domaine de la douleur avec un bon potentiel de bénéfices analgésiques.
Avant d'élaborer sur le soulagement de la douleur avec les opiacés, les co-analgésiques et les approches non pharmacologiques, il est essentiel de bien comprendre le type ou les types de douleurs auxquels on s'adresse, tout comme il importe de bien comprendre les effets des composantes non organiques, i.e. affectives et émotionnelles sur la modulation et la perception globale de la douleur.
Ce n'est qu'après avoir bien compris les bases pathophysiologiques des divers types de douleur qu'il sera possible, dans un deuxième temps, de bien évaluer la douleur.
En conséquence, l'évaluation de la douleur, ou plutôt des divers types de douleur, se devra de reposer, d'abord et avant tout, sur une bonne connaissance de la pathophysiologie des douleurs. Cette évaluation, faite au chevet du patient, se devra de miser sur le meilleur de tous les outils d'évaluation: un questionnaire "bien dirigé" qui soit adressé avec discernement à la personne qui a mal.
Les modalités d'investigation que sont les radiographies, la tomodensitométrie ou tomographie axiale (TACO), la résonance magnétique (RMI) et la médecine nucléaire (Scintigraphie osseuse et TEP), fournissent des renseignements extraordinaires sur l'étendue du fardeau tumoral sans jamais livrer, sur la douleur, les informations capitales que le plus simple questionnaire permet d'obtenir. Ces moyens technologiques très perfectionnés ne fournissent et ne fourniront probablement jamais l'information sur la localisation de la douleur, son intensité et son caractère. Le questionnaire "bien dirigé", lui, permet d'obtenir toutes ces informations.
Ce n'est qu'après avoir procédé à une évaluation des divers types de douleur, en basant cette évaluation sur une bonne connaissance de la pathophysiologie, qu'il sera logique de parler ensuite d'approches adéquates de soulagement des douleurs.
C'est le but de cette série de proposer une base rationnelle à toutes les démarches à visée analgésique.
10 - La première et la plus essentielle des étapes
Voilà donc quelques raisons-clé permettant d'introduire la première et la plus essentielle de toutes les étapes dans le traitement de la douleur:
" le retour à la pathophysiologie de base sans laquelle notre démarche thérapeutique ultérieure risque de n'avoir aucune logique même si elle peut parfois permettre de soulager ou d'atténuer la douleur, comme il a été mentionné dans l'introduction."
En effet, il est possible de soulager ou d'atténuer les douleurs, sans savoir exactement à quel type de douleur on s'adresse, sans même parfois savoir ce qu'on vise exactement avec tel ou tel choix thérapeutique. Le traitement de la douleur se devrait de dépasser les simples recettes, il devrait plutôt toujours tenter de reposer sur une base rationnelle.
La douleur est subjective, toujours subjective. Personne ni même aucune méthode ne peut se substituer à celui ou celle qui a mal pour dire sa douleur. Il est cependant de notre devoir d'essayer de la comprendre dans toute sa dimension avant d'en exercer la gestion. Voilà le but visé par les différents manuels de cette série "Ces personnes qui ont mal".11 - Le principe des principes
La douleur est toujours subjective. Il n'existe aucune méthode ni aucun instrument qui permette d'en quantifier l'intensité de façon objective. Il existe bien sûr des moyens indirects comme la mesure des variations de la respiration ou des battements cardiaques applicables uniquement dans les premiers jours des douleurs aigues, mais ces méthodes ne livrent que des valeurs approximatives.
Dans une monographie publiée en 1984 par Santé et Bien-Etre social Canada, on peut lire l'énoncé suivant qui constitue le premier de tous les principes, le principe des principes, en ce qui concerne la gestion de la douleur:
"La douleur est toujours subjective; elle est ce que le malade affirme et non ce que les autres croient qu'elle devrait être."
Dans les mots de tous les jours, cet énoncé peut se comprendre ainsi:
La douleur est telle que les gens la décrivent et non pas telle que "MOI" je pense qu'elle est.
Cet énoncé constitue le principe fondamental de toute intervention dans le domaine de la douleur. Dans ce champ d'intervention, il n'y a pas de place pour celui/celle qui refuse d'adhérer entièrement à ce principe. Si jamais un/une intervenant(e) quelconque du domaine de la santé se refusait d'adhérer entièrement à ce principe, il serait nettement préférable qu'il/elle laisse sa place à quelqu'un d'autre et cela autant pour ce qui est de l'évaluation des douleurs que pour la gestion de ces mêmes douleurs.
En face d'une personne atteinte de cancer, de SIDA ou en phase palliative d'une autre maladie organique débilitante, il n'y a malheureusement pas de place pour le doute dans le processus d'évaluation des douleurs car aucune personne ou méthode ne peut se substituer à celui ou a celle qui souffre pour décrire sa douleur. Il y a bien assez que la douleur soit "subjective", il n'y a pas de place pour que l'évaluateur (trice) n'ajoute son propre doute comme second niveau de subjectivité dans l'évaluation des douleurs et dans l'élaboration du diagnostic. Il n'est pas souhaitable que la douleur soit alors soumise à la subjectivité d'un "tous et chacun" procédant à l'évaluation. L'adhérence au principe des principes est tout à fait primordiale.
Il y a une autre conséquence au doute car lorsque celui-ci survient, risque d'apparaître en même temps un peu le mépris. On peut alors imaginer combien il devient malheureux pour une "personne qui a mal" de devoir subir, en plus des impacts de sa maladie et de ses douleurs, "le mépris" de certains des intervenants de la santé dont elle est pourtant tributaire pour ses médicaments.
Cette double subjectivité, risque finalement de pénaliser considérablement la personne qui a mal puisque celui/celle qui procède à l'évaluation est souvent celui/celle qui prescrit l'analgésie. Le médecin, qui par la force des choses est toujours "juge et partie" dans tout le processus d'évaluation et de gestion des douleurs, n'est particulièrement pas à l'abri de cette double subjectivité et de ses effets. En devenant mauvais juge, il risque de corrompre "les autres parties", c'est-à-dire les autres soignants et cela, au plus grand détriment de "la personne qui a mal". Rôle délicat, donc, que celui de travailler dans le domaine de la douleur. Rôle qui commande beaucoup d'attention et de délicatesse et même ... beaucoup ... "d'amour" comme nous le verrons dans le chapitre V portant sur les approches non-pharmacologiques.
La personne qui a mal ne devrait jamais se retrouver à la merci des humeurs et des états d'âme des soignants dont elle dépend.
12 - Le principe des principes et l'atteinte cognitive
Cependant, ce principe cardinal risque d'être plus difficilement respecté et applicable dans le cas des personnes ayant une atteinte cognitive car il risque de perdre tout son sens. En effet, le principe selon lequel "La douleur est telle que les gens la décrivent ..." perd alors toute sa signification car le patient ne peut décrire sa douleur, ou encore, la description qu'il en fait risque d'être dénudée de toute valeur informative; le piège de l'interprétation subjective s'ouvre alors tout grand. Malheureusement, aucun moyen technique ni aucune investigation perfectionnée ne permettent d'obtenir l'information qu'une saine communication apporte lorsqu'un questionnaire judicieusement orienté est adressé à la personne qui souffre.
Dans le cas des personnes ayant une atteinte cognitive, il faut donc revenir à des critères d'évaluation à tout le moins reproductibles afin que cette évaluation se fasse le plus objectivement possible. En présence d'une atteinte cognitive, le défi devient donc énorme. Aucun de nous ne doute que ces personnes puissent éprouver de la douleur. Elles sont cependant incapables de nous dire leurs douleurs avec des mots. Nous aborderons ce thème en détail dans le Manuel II portant sur l'évaluation des douleurs.
13 - La gestion appropriée de la douleur: six éléments-clé
La gestion appropriée de la douleur est l'objectif final de toutes nos interventions.
Cependant, pour atteindre une gestion appropriée de la douleur, il est essentiel que chacune des interventions repose sur six éléments-clé.
Premièrement,
la gestion appropriée de la douleur sous-entend une connaissance adéquate des divers types de douleur sur laquelle cette maîtrise repose. Quand on travaille dans le domaine de la gestion analgésique, on réalise rapidement, dans un certain sens, que "la" douleur n'existe pas! Le terme "douleur", comme on y fait référence généralement, représente plutôt un ou plusieurs types de douleurs, caractérisés par un ou par divers mécanismes pathophysiologiques bien distincts.
La douleur n'existe pas plus que la couleur. La couleur se définit par ses composantes, c'est-à-dire le bleu, le jaune, le rouge, etc. Il en va de même pour la douleur.
Cette affirmation doit bien sûr être considérée dans un contexte clinique où le défi consiste à distinguer les divers types de douleur en cause afin de choisir la ou les meilleures approches analgésiques.
Il faut donc apprendre à traiter chacune des pathophysiologies de la douleur et non pas la douleur dénuée de tout substrat pathophysiologique. Il faut simultanément tenir compte de l'intégration des nombreuses composantes physiques et non-physiques et non seulement de la pathophysiologie organique en cause.
Deuxièmement,
pour tenter d'offrir une gestion appropriée de la douleur, il faudrait que l'évaluation de la ou des douleur(s) soit guidée par cette connaissance de ce que sont les divers types de douleur.
Troisièmement,
une fois le diagnostic d'un ou de divers types de douleur établi, la gestion appropriée de la douleur devrait reposer sur une bonne connaissance des analgésiques, qui sont en fait les opiacés, et des co-analgésiques qui regroupent l'ensemble de tous les autres médicaments dotés, pourrait-on dire, d'un effet secondaire "désirable", c'est-à-dire un effet analgésique.
Quatrièmement,
la gestion appropriée de la douleur exige que la personne traitée, sa famille et/ou ses proches soient bien informés sur le ou les médicaments utilisés, les posologies et les effets secondaires. L'ensemble des interventions à visée analgésique doit aussi reposer sur une collaboration optimale entre la personne atteinte et celui/celle qui prescrit. Cette condition pose un problème majeur en présence d'une atteinte cognitive.
Cinquièmement,
si on utilise des opiacés, il est extrêmement important que l'on identifie les mythes, les peurs, les craintes et les résistances qui entourent l'emploi de ces médicaments. Il peut être tellement désolant qu'une prescription d'opiacés ne soient pas utilisés "comme prescrits" une fois à domicile alors que ces personnes étaient pourtant adéquatement soulagées avec un opiacé à l'hôpital mais à leur insu. Le seul fait d'entendre le mot "morphine" ou de lire "narcotique" sur la bouteille de prescription peut faire en sorte que certaines personnes puissent refuser de prendre leur médication. A l'hôpital, "le médicament" qu'on administrait était tout bonnement appelé "médicament contre la douleur" ou encore, on identifiait le médicament sous son nom commercial, chacun prenant bien soin de ne pas prononcer le mot "MORPHINE" ou "NARCOTIQUE" pour ne pas avoir à éveiller des soupçons, des questions ou des résistances.
Pas très honnête, à première vue, dans la façon de faire!
Imaginons un peu maintenant que cette "minime" tromperie, dans le mode d'usage, s'ajoute aux doutes projetés sur la personne qui a mal et qui ont cours durant le processus d'évaluation de la douleur !!! Doutes et tromperies: quelle élégante combinaison comme préliminaire aux interventions à visée analgésique !!!
Sixièmement,
il sera nécessaire d'aborder la douleur suivant une perspective de gestion globale et non pas uniquement de traitement, ceci afin d'inclure tous les moyens et toutes les interventions que l'approche multidisciplinaire peut offrir. On peut donc espérer que, de cette façon, l'approche devienne multidimensionnelle, et rejoigne ainsi les nombreux impacts de la maladie, c'est-à-dire la douleur "dans le corps" et la douleur "dans l'âme".
En effet il est bien connu que plusieurs types de douleur peuvent coexister chez une même personne. Or, les composantes non-physiques de la vie, que l'on regroupe habituellement sous le vocable "psycho-socio-spirituelles", modulent considérablement la douleur physique. Malheureusement, cette modulation se fait souvent dans le sens d'une intensification. Ce rehaussement de la douleur causé par les éléments non-physiques ne répond nullement aux opiacés et ne répondra pas même si on augmente la dose. Les opiacés n'ont pas d'effets anxiolytiques; ils sont des analgésiques.
Si on ne parvient pas à équilibrer notre gestion de la douleur grâce à une combinaison d'approches multidisciplinaires et multidimensionnelles, on risque de ne pas atteindre les objectifs fixés et, donc, de ne pas offrir l'analgésie souhaitée qu'il aurait été possible d'obtenir, si on s'était donné la peine de recourir à d'AUTRES moyens que la pharmacothérapie uniquement.
14 - Choix aléatoires, résultats aléatoires
Par le non-respect des éléments-clé de la maîtrise de la douleur, on risque de n'utiliser que l'approche pharmacologique. Pire encore serait de recourir à une démarche pharmacologique sans que le choix du ou des médicaments appropriés ne repose sur un fondement logique.
Les médicaments sont alors employés au gré du hasard, choisis subjectivement sous le coup d'une inspiration subite ou en raison d'une certaine aisance à manipuler préférentiellement tel ou tel médicament.
Dans une telle situation, l'interrogation, pour celui ou celle qui prescrit, s'arrête à un choix "aléatoire" parmi une simple liste de médicaments à peu près tous égaux, puisqu'aucun motif "rationnel" ne guide la prescription qui est faite. Pourtant, celui ou celle qui prescrit se trouve au centre d'un large arsenal de médicaments reconnus pour soulager la douleur mais avec des indications particulières pour chacun et le/les choix qu'il/elle fait parmi l'arsenal aurai(en)t donc dû reposer sur des critères rationnels au lieu de reposer sur des effets présomptifs ou sur la méthode "par tâtonnement". Le non-respect des éléments-clé de la maîtrise de la douleur risque donc de se faire au détriment de la personne qui a mal en ajoutant une kyrielle d'effets secondaires à l'absence de soulagement espéré.15 - La première partie de ce manuel expose ... les nécessaires éléments d'anatomophysiologie et de pathophysiologie
La première partie de ce manuel expose les nécessaires éléments d'anatomophysiologie et de pathophysiologie sur lesquels devraient reposer toute notre conduite ultérieure face aux douleurs.
De telles notions veulent fournir une base logique et rationnelle à la gestion des douleurs. Leurs détails anatomophysiologiques et pathophysiologiques devraient permettre de cerner les mécanismes en cause par lesquels chaque personne trouve mille et une façons, qui lui sont propres, d'exprimer ses douleurs.
16 - Douleurs physiques: prévalence
La douleur physique occupe une place centrale dans le contexte des soins palliatifs. Elle représente le premier objectif auquel il faut s'adresser.
Les cancers les plus fréquents sont malheureusement en même temps ceux qui sont responsables d'un taux très élevé de douleur. N'aurait-on pu souhaiter que les cancers les plus fréquents soient ceux donnant le moins de douleur! Il n'en est malheureusement pas ainsi!
La douleur peut se retrouver selon les études chez 60-80 % des personnes en soins palliatifs. Dure réalité, incontestablement, mais il est heureusement possible de venir en aide à un fort pourcentage de "ces personnes qui ont mal". C'est ce qu'une bonne évaluation devrait permettre.
17 - La douleur et son lexique
Le domaine de la douleur possède, comme tous les autres domaines de la santé, son jargon propre. Autour du thème de la "DOULEUR" existe tout un lexique de mots qui tentent de décrire, de façon spécifique, différentes structures, différentes présentations cliniques et différents concepts.
Parmi la nomenclature descriptive se retrouvent les termes suivants:
- nociception
- allodynie
- analgésie
- anesthésie
- hyperalgésie
- hyperesthésie
- hyperpathie
- paresthésie
- dysesthésie
- douleur neurogène ou neuropathique.
Il existe encore de nombreux autres termes appartenant au lexique de la douleur, mais ils n'ont pas été retenus en regard des objectifs de cette présente série.
18 - Douleur - nociception: définition
De simple figurant dans le vocabulaire quotidien, la "DOULEUR" est désignée dans le jargon des sciences de la santé par le mot "NOCICEPTION". Il existe bien sûr une définition spécifique de la douleur qui sera discuté un peu plus loin dans le présent document
La NOCICEPTION pour sa part peut être comprise comme la perception par le cerveau de l'influx électrique cheminant dans les fibres du réseau nerveux nociceptif (axones, nerfs, racines, tractus/faisceaux ascendants spinothalamique et autres) et transportant donc l'information "douleur". L'IASP définit la nociception de la façon suivante: (traduction libre)
"une énergie thermique ou mécanique potentiellement dommageable pour les tissus qui est exercée sur une fibre nerveuse spécialisée particulièrement A delta et C" (IASP - 1994). En fait, la nociception n'est rien d'autre qu'une perception sensitive parmi bien d'autres, tout comme le son, la vue, le goût, à la différence peut-être qu'elle est une perception toujours dérangeante, souvent même, extrêmement dérangeante. Ces différentes sensations (son, vue, goût) originent de récepteurs particuliers, oreille, oeil, papilles gustatives. Elles sont, chacune, véhiculées par une variété de fibres nerveuses du réseau sensitif. Ces fibres, chacune spécialisée dans le transport d'un type d'influx spécifique, arrivent vers des zones particulières du cerveau qui ont, comme fonction première, d'interpréter l'information électrique "particulière" qui leur est ainsi apportée.
Ainsi, l'ouïe pourrait être décrite comme la perception de l'activité électrique neuronale transportant l'information "son" vers le cerveau, ainsi la vue pour l'information "image" et le goût pour l'information "gustative".
Les récepteurs de la douleur s'appellent des NOCICEPTEURS.
19 - Un lexique "douloureux"
Les définitions proposées dans les lignes qui suivent sont celles retenues par le groupe de travail sur la taxonomie (Task Force on Taxonomy) de l'IASP et publiées en 1994. Elles sont une traduction libre de la version anglaise et contiennent une annotation complémentaire proposée à titre d'éclaircissement dans certains cas.
- ALLODYNIE
"douleur résultant d'un stimulus qui ne provoque habituellement pas de douleur".
Dans ce cas, la sensation douloureuse éprouvée ne possède aucun lien quelconque avec la stimulation provoquée comme lorsqu'une douleur est créée par le fait de toucher superficiellement une région. Le coup de soleil en est un bon exemple.- ANALGESIE
"absence de douleur en réponse à une stimulation qui devrait normalement être douloureuse".
- La définition puriste avance le concept d'"absence de douleur ..." mais en fait, l'analgésie, telle que vécue tous les jours, est habituellement la résultante de manoeuvres pharmacologiques ou autres appliquées sur une ou plusieurs composantes du réseau nociceptif et qui ont pour effet de réduire ou d'éliminer la sensation douloureuse ressentie par l'application de stimulus douloureux. On dit qu'une substance est analgésique ou encore qu'une technique ou une manoeuvre possède des effets analgésques.
- ANESTHESIE
"perte complète de toute sensibilité dans une région donnée".
Cette perte concerne toutes les sensibilités possible, le toucher léger, la piqûre, le sens du positionnement etc. On dit que la région est "gelée".- HYPERALGESIE
"une réponse augmentée (ou exagérée) à un stimulus douloureux".
- A la différence de l'allodynie, le stimulus, dans le cas de l'hyperalgésie, doit être douloureux au départ mais alors il existe une nette disproportion entre l'intensité du stimulus douloureux appliqué et l'intensité de douleur ressentie lors de l'application de ce même stimulus. Le stimulus douloureux n'aurait pas dû causer autant de douleur.
- HYPERESTHESIE
"sensibilité augmentée à tout type de stimulation (autre que douloureux) excluant cependant les sens spéciaux".
La sensation éprouvée est alors concordante avec la stimulation provoquée (par exemple gratter la peau avec les soies d'une brosse et ressentir la sensation de grattage) mais son intensité est nettement exagérée par rapport à l'intensité du stimulus. De plus, elle est ressentie comme normale i.e. qu'elle appartient à la gamme des sensations cutanées normales.
- Les sens spéciaux exclus dans la présente définition comprennent à titre d'exemple l'odorat, l'audition, la vue, le goûter.
- HYPERPATHIE
"un syndrome douloureux caractérisé par une réponse douloureuse nettement exagérée découlant de stimuli répétitifs, incluant en même temps une élévation de seuil".
Dans ce cas, la sensation douloureuse éprouvée peut découler d'une stimulation véritablement douloureuse ou d'une stimulation totalement indolore. Dans le contexte d'hyperpathie, la douleur éprouvée ne possède aucun lien quelconque ni avec le type de stimulation provoquée, ni dans le caractère de la douleur ressentie, ni dans l'étendue de cette même douleur. A ce titre, on peut comprendre l'hyperpathie comme étant la résultante d'une combinaison à la fois d'allodynie et d'hyperesthésie dans un contexte cependant où les stimulations ont été appliquées de façon répétées et soutenues. La répétition soutenue des stimulations entraîne une élévation progressive du seuil d'activation des "nocicepteurs" de sorte qu'il faut des stimuli (douloureux ou autres) de plus en plus intenses pour provoquer de la douleur mais lorsque ces stimuli finissent par provoquer de la douleur, cette douleur est infiniment intense et beaucoup plus étendue que ce à quoi on devrait s'y attendre. La douleur ressentie possède alors l'intensité d'une douleur explosive qui se propage parfois sur un grand territoire.- PARESTHESIE
"une sensation anormale (non-douloureuse), qu'elle soit spontanée ou provoquée".Cette sensation peut découler bien sûr d'un stimulus identifié mais en clinique elle découle souvent, à ses débuts, d'une origine "inapparente" comme dans le cas de lésions nerveuses qui vont finir par se révéler de façon plus probante avec le temps pour devenir même des douleurs neurogènes (ou neuropathiques).
Il est important de noter que pour qu'une sensation soit paresthésique, elle doit être différente des sensations dites "normales" qu'il est habituellement possible de provoquer. Ainsi, une sensation paresthésique peut être de type "fourmillements, picotements ou engourdissements", sensations qu'il n'est généralement pas possible de produire par stimulations, et en même temps être d'un niveau d'intensité "acceptable" i.e. non douloureux. Elle ne doit cependant pas être à ce point anormale et intense qu'elle devienne "désagréable ou déplaisante" car alors une autre nomenclature s'applique, cette paresthésie devient dysesthésie.
- DYSESTHESIE
"une sensation anormale "désagréable ou déplaisante", qu'elle soit spontanée ou provoquée".
Cette sensation peut découler bien sûr d'un stimulus identifié mais en clinique elle découle le plus souvent d'une origine "inapparente" comme dans le cas des douleurs provenant de lésions nerveuses (douleurs neurogènes ou neuropathiques).
Il est important de noter, tout comme pour la sensation paresthésique, que pour qu'une sensation soit dysesthésique, elle doit être différente des sensations dites "normales" qu'il est habituellement possible de provoquer et en même temps être d'un niveau d'intensité qualifié d'inacceptable. La sensation "dysesthésique" doit ainsi être à ce point anormale et intense qu'elle devienne "désagréable ou déplaisante". Ainsi, les fourmillements, picotements ou engourdissements deviendront d'une intensité inqualifiable. Les brulûres pour leur part deviendront "cuisantes" ou "comme des torches allumées". Rien de comparable donc avec l'intensité "paresthésique".- DOULEUR NEUROGENE OU NEUROPATHIQUE
"une douleur initiée ou causée par une lésion primaire, une dysfonction, ou une perturbation transitoire dans le système nerveux périphérique ou central".
Cette douleur résulte donc la plupart du temps d'une agression de quelque origine que ce soit (compression, traumatisme etc,) sur une ou des composantes du circuit nerveux nociceptif. Cette agression peut avoir eu lieu ou a lieu spécifiquement au moment où la douleur est ressentie. Dans les documents qui suivent, le terme "douleur neurogène" sera presque toujours celui utilisé.20 - La douleur: résumé anatomo-physiologique "simplifié" et "vulgarisé"
- des "récepteurs de la douleur" situés en périphérie. Ces récepteurs sont plus correctement appelés nocicepteurs, d'où l'expression "douleur nociceptive". La douleur ressentie par la piqûre d'une aiguille ou lors d'une entorse en sont des exemples.
- d'une région sur le neurone nociceptif (ou fibre nociceptive) où se déroule une agression mineure ou majeure ou encore d'une région sur le neurone nociceptif où une agression a définitivement créé une lésion. On parle alors de "douleur neurogène". L'inconfort ressenti sous forme de douleur-engourdissement-brûlure lorsqu'une jambe demeure longtemps croisée en est un exemple.
Les pages qui suivent ont pour objet d'expliciter ce bref résumé.
21 - Les récepteurs de la douleur: les nocicepteurs
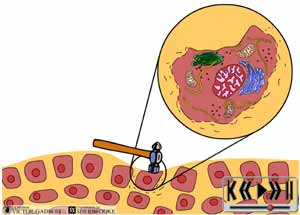
Le modèle classique de la douleur débute avec la provocation d'un stimulus "douloureux" qui déclenche la production d'un influx "douloureux". Pour qu'il y ait influx douloureux, il faut d'abord que certains nerfs soient capables de reconnaître un stimulus nociceptif et c'est le fait des neurones nociceptifs. Ce stimulus douloureux n'est habituellement "reconnu" que par les extrémités des neurones nociceptifs, extrémités auxquelles on réfère comme étant des "terminaisons nerveuses". Chaque neurone "nociceptif" possède une abondance de terminaisons nerveuses un peu comme chaque branche d'un arbre possède de nombreuses ramifications.

ANIMATION 21.1 Ainsi est créée "la douleur nociceptive".
Les terminaisons nerveuses des neurones nociceptifs jouent le rôle de "senseurs" à la douleur. Ces "senseurs" aux stimuli douloureux sont qualifiés de récepteurs de la douleur et sont préférablement identifiés comme étant des nocicepteurs.
Les nocicepteurs sont en fait des "traducteurs" de signal puisqu'ils "traduisent" un certain type de signal (coup de marteau sur un pouce) en un autre type (influx électrique douloureux). Dans le jargon de la physique, on les qualifie de "transducteurs" et la traduction d'une sorte de signal en un autre s'appelle la "transduction".
Différents types de nocicepteurs existent malgré le fait que leur apparence anatomique soit identique, ils sont tous des terminaisons nerveuses dénudées de myéline, on les dit "terminaisons libres". Ils sont souvent classifiés selon leurs réponses à différents stimuli "douloureux". Certains ne répondent sélectivement qu'à une seule sorte de stimulus, d'autres répondent à divers types de stimuli.
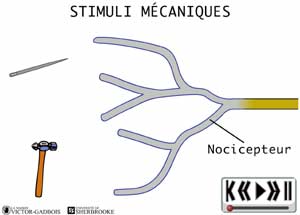
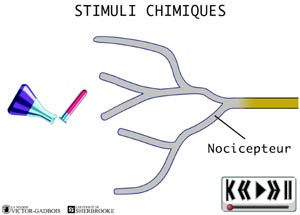
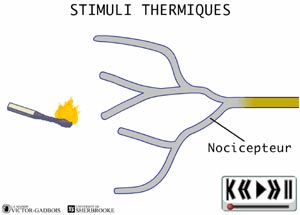
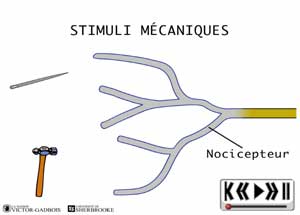
Les nocicepteurs peuvent répondre à trois types de stimuli:
- mécanique (pression, étirement)
ANIMATION 21.2 - thermique (chaud et froid)
ANIMATION 21.3 - chimique (des substances endogènes et exogènes).
ANIMATION 21.4
22 - Les différents types de nocicepteurs
Il reste étonnant de constater combien il est demeuré jusqu'à maintenant difficile, voire impossible, d'identifier, sur le plan histologique, des structures spécifiques faisant office de "récepteurs de la douleur" alors que de nombreux autres "détecteurs sensitifs ou senseurs" sont connus depuis fort longtemps. Les nocicepteurs semblent réussir à garder le secret de leur histologie, ils apparaissent tous comme des "terminaisons libres" alors que l'existence même de la douleur ne fait de doute pour personne ... sur cette terre.
Ils sont appelés "terminaisons libres" en raison du fait qu'ils ne possèdent aucun recouvrement d'aucun type, ni capsule, ni myéline. Cependant, un certain nombre de ces récepteurs, en l'occurence certains récepteurs polymodaux parmi ceux décrits dans les lignes qui suivent, peuvent être recouverts d'une très fine couche de myéline tellement négligeable pourtant que tous les nocicepteurs sont qualifiés de "terminaisons libres" i.e. non-myélinisées.
Les études sur la douleur se sont concentrées depuis longtemps sur les stimulations cutanées en raison, de toute évidence, de la facilité de provoquer des stimuli nociceptifs de divers ordres sur la peau.
La littérature actuelle reconnaît quatre principaux types de nocicepteurs au niveau cutané:
- les récepteurs sensibles à la pression, aussi appelés mécanosensibles ou MECANORECEPTEURS.
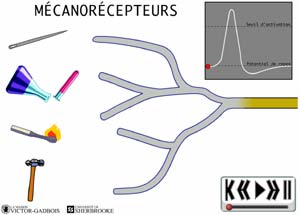
ANIMATION 22.1 Ces nocicepteurs produisent des influx "douloureux" dont la fréquence est proportionnelle à l'intensité de la pression ou de la tension exercée. Ils sont particulièrement sensibles aux stimulations par des objets pointus (aiguilles). En fait, ces mécanorécepteurs réagissent à des stimuli de faible intensité (aiguille vs marteau!). Ils sont qualifiés de récepteurs à bas seuil (low threshold) et sont connectés à une sorte de neurones ou fibres nociceptives, les fibres A delta. Ils ne sont présents que dans la peau.
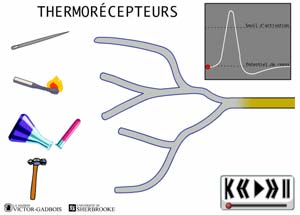
ANIMATION 22.2 - les récepteurs sensibles à la température, aussi appelés thermosensibles ou THERMORECEPTEURS.
ANIMATION 22.3 Ces nocicepteurs produisent des influx "douloureux" dont la fréquence est aussi proportionnelle à l'intensité du degré de stimulus thermique exercé. Ils sont qualifiés de récepteurs à bas seuil (low threshold). Ils sont connectés à une ou l'autre des deux sortes de fibres nociceptives, les fibres A delta ou C. Les fibres C des thermorécepteurs ne conduisent que les influx provenant de ces mêmes thermorécepteurs. Elles ne conduisent pas les influx provenant des autres types de nocicepteurs. Ainsi, les fibres C branchées aux thermorécepteurs ne possèdent pas de branchements avec les autres récepteurs mécanothermiques et polymodaux. En fait, les fibres C ne sont donc jamais connectées en même temps à divers types de nocicepteurs.
ANIMATION 22.4 - les récepteurs sensibles à la pression et à la température, aussi appelés RECEPTEURS MECANOTHERMIQUES.
ANIMATION 22.5 Ces nocicepteurs ne produisent des influx "douloureux" qu'à la suite de fortes intensités de pression ou de température exercées. Ils sont des récepteurs à seuil élevé ou à haut seuil d'activation (high threshold) parce que seule une forte stimulation nociceptive peut déclencher un influx douloureux. Ils sont préférentiellement connectés à des fibres C qui encore leurs sont propres.
ANIMATION 22.6 - les RECEPTEURS POLYMODAUX ... les plus abondants parmi tous les nocicepteurs
ANIMATION 22.7 Ces nocicepteurs produisent des influx "douloureux" en réponse à différents types de stimuli exercés: pression/étirement, température, substances chimiques. Ils sont responsables du caractère de brûlure et/ou d'élancement des douleurs, de la localisation "vague, diffuse et imprécise" de ces mêmes douleurs tout comme du degré d'intensité décrit comme "intolérable ou désagréable" . Ils nécessitent des stimulations "fortes" pour être activés. Ils sont les nocicepteurs au seuil le plus élevé d'activation qui soit (high threshold). En fait , ils sont les derniers à réagir dans l'échelle d'intensité des stimuli douloureux.
ANIMATION 22.8 La très très grande majorité des récepteurs polymodaux sont connectée à des fibres C. Un petit nombre de ces mêmes récepteurs sont aussi connectés à des fibres A delta, ils peuvent alors être recouvert d'une couche négligeable de myéline tel que mentionnné ci-haut.
Parmi tous les nocicepteurs énumérés, les récepteurs polymodaux représentent plus de 75-80 % de tous les nocicepteurs. C'est dont dire l'importance de la contribution des nocicepteurs polymodaux dans la perception de la douleur et l'importance de la conduction nociceptive par les fibres C qui leur sont "branchées".
En dehors des structures cutanées, les récepteurs polymodaux prédominent partout de façon écrasante puisqu'ils constituent l'exclusivité presque totale parmi les récepteurs nociceptifs au niveau de toutes les structures viscérales. On les retrouve presque partout dans les viscères, ils savent réagir à l'ensemble des différents stimuli pouvant causer de la douleur dans les viscères: l'étirement et la compression figurent parmi les exemples de stimuli mécaniques, l'ischémie et l'inflammation pour les stimuli chimiques. Les stimuli thermiques ne causent pas de douleur à l'intérieur des viscères, à titre d'exemple, l'oesophage et l'estomac ne renvoient pas de sensations douloureuses lorsque des liquides/aliments très chauds sont ingérés, tout au plus ressent-on une certaine sensation de chaleur mais qui n'est pas de la douleur. La bouche pour sa part répond par de la douleur aux stimulations provoquées par des aliments très chauds.
Enfin, certaines structures, reconnues pour être "sans pardon" quant à leur capacité de générer des douleurs, ne sont pourvues que de récepteurs polymodaux (terminaisons libres). Ces structures figurent au nombre de trois, ce sont:La moindre "poussière cornéenne" représente un "enfer", quand au "mal de dent", cette entité est passé à l'histoire depuis la nuit des temps. Pour ce qui est du "mal d'oreille", nos parents peuvent nous raconter combien cela a pu "raccourcir" certaines de leurs nuits et nous comme parents pouvons en dire autant. Après ces trois exemples de "calamités douloureuses", il est difficile de demeurer incrédule face au rôle des récepteurs polymodaux (terminaisons libres) et des fibres C dans la genèse des pires douleurs.
Les terminaisons libres se terminent comme de fins embranchements multiétalés. Chaque terminaison libre recouvre une portion de plusieurs autres de sorte qu'il existe un important chevauchement de plusieurs terminaisons libres dans un centimètre cube de tissu innervé.
- la cornée,
- la pulpe dentaire
- le tympan.
23 - Les nocicepteurs: leurs localisations
- la surface cutanée répond aux stimuli
• mécaniques • thermiques • chimiques (exogènes et endogènes)
Elle est donc pourvue de récepteurs
• mécanorécepteurs • thermorécepteurs • récepteurs mécanothermiques
• récepteurs polymodaux
- les muscles squelettiques répondent particulièrement à des stimuli
• chimiques (exogènes et endogènes)
- Dans un tel contexte, ce sont des substances produites en contexte d'hypoxie ou d'anaérobie relative (par exemple de l'acide lactique) qui font office de stimulants chimiques endogènes.
Ils sont donc pourvus de
• récepteurs polymodaux réagissant à différentes substances chimiques (acide lactique)
- le muscle cardiaque répond à des stimuli
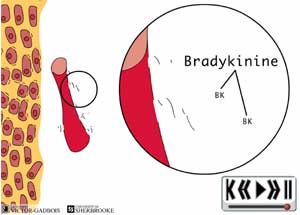
• mécaniques • thermiques • chimiques (à ce niveau, c'est l'hypoxie qui joue un rôle déclenchant et qui entraîne la production d'acide lactique, de prostaglandines, histamine, bradykinine, sérotonine)
Il est pourvu de
• mécanorécepteurs • thermorécepteurs • récepteurs polymodaux réagissant à différentes substances chimiques découlant de l'hypoxie (acide lactique, prostaglandines, histamine, bradykinine, sérotonine). Ces différents nocicepteurs sont presque exclusivement connectées à des fibres C.
- les articulations répondent à des stimuli
• mécaniques • chimiques (à ce niveau, c'est l'inflammation qui joue le rôle déclenchant et qui entraîne la production de prostaglandines, histamine, bradykinine, sérotonine) Elles sont pourvues de
• mécanorécepteurs • récepteurs polymodaux réagissant à différentes substances chimiques découlant de l'inflammation (prostaglandines, histamine, bradykinine, sérotonine).
- le périoste répond à des stimuli
• mécaniques • chimiques (à ce niveau, c'est l'inflammation qui joue le rôle déclenchant et qui entraîne la production de prostaglandines, histamine, bradykinine, sérotonine) Il est pourvu de
• mécanorécepteurs • récepteurs polymodaux réagissant à différentes substances chimiques découlant de l'inflammation (prostaglandines, histamine, bradykinine, sérotonine).
- les viscères répondent à des stimuli
• mécanorécepteurs • thermorécepteurs • récepteurs polymodaux réagissant à différentes substances chimiques découlant de l'hypoxie (acide lactique, prostaglandines, histamine, bradykinine, sérotonine). Ces différents nocicepteurs sont presque exclusivement connectées à des fibres C.
Ils sont pourvus de
• mécanorécepteurs • thermorécepteurs • récepteurs polymodaux réagissant à différentes substances chimiques découlant de l'hypoxie (acide lactique, prostaglandines, histamine, bradykinine, sérotonine). Ces différents nocicepteurs sont presque exclusivement connectées à des fibres C.
- les vaisseaux sanguins répondent à des stimuli
• mécaniques • chimiques (à ce niveau, c'est l'inflammation qui joue le rôle déclenchant et qui entraîne la production de prostaglandines, histamine, bradykinine, sérotonine) Ils sont pourvus de
• mécanorécepteurs • récepteurs polymodaux réagissant à différentes substances chimiques découlant de l'inflammation et l'hypoxie (prostaglandines, histamine, bradykinine, sérotonine). Ces différents nocicepteurs sont presque exclusivement connectées à des fibres C. De nombreuses autres structures sont pourvues de nocicepteurs, l'énumération actuelle des exemples a été choisi en raison de la haute prévalence de douleurs dans ces différentes structures. Les dernières structures proposées sont souvent oubliés, il ne faut pourtant pas oublier que les douleurs "vasculaires" existent bel et bien en raison de la présence de nocicepteurs à la surface des vaisseaux sanguins.
Même si on retrouve des nocicepteurs en grand nombre dans de très nombreuses structures anatomiques, les nocicepteurs ne sont pas présents partout. A titre d'exemple, le cortex cérébral n'est pas doté de nocicepteurs, le poumon est dépourvu de nocicepteurs tout comme le foie, la paroi intestinale est insensible aux pinces que le chirurgien applique et l'intérieur de la cavité utérine n'est pas non plus sensible lors des curetages utérins.
Les nocicepteurs, peu en importe le type, ont donc comme fonction de "traduire" différents modes de signaux en des signaux "électriques".
Cette transduction d'une sorte de stimulation en signaux électriques est induite par des changements observables et mesurables au niveau des charges électriques réparties de chaque côté de la membrane du neurone (membrane neuronale). On réfère à ce phénomène de changements des charges électriques de part et d'autre de la membrane comme étant une dépolarisation membranaire.
24 - Les autres informations sensitives et leurs récepteurs
D'autres informations sensitives en provenance des structures somatiques (peau, système musculo-squelettique) existent. Ces informations ne sont pas dérangeantes cependant. Elles relèvent, elles aussi, de récepteurs divers qui, eux, ne sont pas sensibles i.e. ne réagissent pas aux stimulations douloureuses. Cependant lorsque leur stimulation devient très intense, ces récepteurs peuvent alors transmettre des influx à tonalité nociceptive et contribuer ainsi à l'amplification des messages douloureux arrivant à la moelle.
Parmi les informations sensitives non-nociceptives, figurent:
- la proprioception consciente i.e. la discrimination tactile (discrimination deux points), le sens de la position, le sens de vibration ainsi que la proprioception inconsciente
et- le toucher léger superficiel.
Ces deux grands types d'information originent de récepteurs histologiquement fort différents les uns des autres et sont acheminés vers les centres supérieurs par des circuits ou faisceaux différents.
La discrimination tactile et la proprioception proviennent de récepteurs qui informent sur:
- le degré d'étirement musculaire (information kinesthésique)
- l'angle de positionnement d'une articulation (information kinesthésique)
- le mouvement d'une articulation (information kinesthésique)
- la rapidité de mouvement d'une articulation (information kinesthésique)
- les stimulations cutanées vibratiles (sens de la vibration)
- la discrimination tactile (discrimination deux points)
- la discrimination tactile complexe discriminative (par exemple identifier une pièce de monnaie dans la main)
- le sens de la position, le sens de vibration
- le degré de pression subi par la surface cutanée.
Ces informations sont obtenues grâce à différents récepteurs "encapsulés" (donc fort différents des terminaisons libres) parmi lesquels figurent:
- les fuseaux musculaires (muscle spindles). Les fuseaux neuromusculaires sont disposés entre les fibres musculaires des muscles striés.
- les organes tendineux de Golgi (Golgi tendon organ). Les organes tendineux de Golgi sont situés aux jonctions musculo-tendineuses.
- les récepteurs ou corpuscules de Ruffini. Ces récepteurs sont situés à différents endroits, dans le tissu conjonctif du derme profond où ils sont sensibles sensibles à la pression et à l'étirement de la peau, au niveau des capsules articulaires où ils sont profondément ancrés aux ligaments. Au niveau des articulations, ils représentent la majorité des récepteurs articulaires. Ils participent aussi aux sensibilités thermiques du chaud par leur présence dans le derme profond.
- les corpuscules de Krause. Ces récepteurs situés sous la couche basale de l'épiderme participent à la sensibilité thermique du froid.
- les corpuscules de Pacini (Pacinian corpuscles). Les corpuscules de Pacini se retrouvent dans le tissu adipeux et le tissu conjonctif sous-cutané du derme ainsi que dans les tendons et les régions articulaires. Ces récepteurs sont particulièrement sensibles aux moindres vibrations et à toute déformation cutanée de l'ordre du nanomètre, ils ont ainsi une extrême sensibilité à détecter tout mouvement de l'ordre de quelques nanomètres et à filtrer tout stimulus de basse fréquence.
- les disques de Merkel. Ces récepteurs sont situés dans la couche profonde de l'épiderme particulièrement dans le bout des doigts. Ils sont responsables de la perception de la forme et de la texture en raison de leur extrême sensibilité aux stimulations provenant de pointes, d'arêtes et de courbure et de leur discrimination spatiale très marquée de l'ordre de 0.5 mm.
- les corpuscules de Meissner (Meissner's corpuscles) sont situés immédiatement sous l'épiderme dans les papilles dermiques. Ces récepteurs participent au toucher superficiel complexe. On les retrouve particulièrement au niveau de la paume de la main, de la plante du pied et des organes génitaux.
- et d'autres récepteurs encapsulés qui se retrouvent dans les muscles, les tendons, les ligaments, les articulations, au pourtour des racines des poils et dans la peau.
Ces différents récepteurs qui informent sur la localisation spatiale et sur la perception de la taille et de la forme d'un objet, sont connectés à des grosses fibres nerveuses (A alpha et A bêta) qui forment leur propre réseau ou faisceau lors de l'ascension de ces informations par les cordons postérieurs vers le cerveau, A partir des étages du tronc cérébral, ces informations sont véhiculées par le réseau lemniscal qui fait son ascension vers le thalamus.
Presque tous ces récepteurs peuvent, à stimulation intense, générer des influx à tonalité nociceptive. Ainsi à titre d'exemple, malgré son encapsulement en pelure d'oignon, le corpuscule de Pacini peut générer de la douleur lorsqu'il est soumis à de fortes pressions.
Le toucher léger superficiel provient pour sa part de récepteurs (corpuscules de Meissner et de Merkel) la sensibilité tactile superficielle qui informent:
- sur la sensibilité tactile superficielle i.e. le contact léger superficiel avec la peau originant
- d'un très léger effleurement
- d'une très légère pression.
- sur la localisation de cette fine stimulation mais cette information, transmise par les récepteurs du toucher léger superficiel le serait de façon "vague et imprécise" si ce n'était de la participation des récepteurs proprioceptifs.
Les récepteurs qui informent sur le contact léger superficiel avec la peau et la localisation spatiale "vague et imprécise" sont connectés à des fibres nerveuses de petits calibres, les fibres A delta, qui forment elles aussi leur propre réseau lors de l'ascension de ces informations vers le cerveau.
Les informations du toucher léger superficiel sont ainsi acheminées elles aussi par des fibres qui lui sont spécifiques. Ces fibres cheminent à travers celles du réseau néo-spinothalamique qui est celui qu'empruntera une partie des informations nociceptives dans leur ascension vers les centres supérieurs. Plus d'un types d'information seront donc transportés dans ce réseau (Voir: LE SYSTEME DE TRANSPORT DES INFLUX NOCICEPTIFS: LA PORTION CENTRALE D'ORIGINE MEDULLAIRE).
25 - Le phénomène de dépolarisation "membranaire" et le seuil d'activation
Le processus de dépolarisation membranaire se déroulant au moment de la transduction d'un type quelconque de stimulation en signal électrique tel qu'introduit plus avant (Voir: LES NOCICEPTEURS: LEURS LOCALISATIONS) revêt une importance fondamentale puisqu'il touche l'essence même du mécanisme physiologique à l'origine de tout influx électrique dans un neurone et donc de tout influx douloureux. Par ailleurs, il est non seulement fondamental pour comprendre la "naissance" d'un influx douloureux mais il est aussi à la base des effets pharmacologiques de plusieurs médicaments utilisés en visée co-analgésique parmi lesquels se retrouve les anticonvulsivants et les antiarythmiques. Ces notions seront abordées dans le manuel III de la présente série (La gestion analgésique avec les co-analgésiques).
Qu'en est-il donc du processus de dépolarisation membranaire?
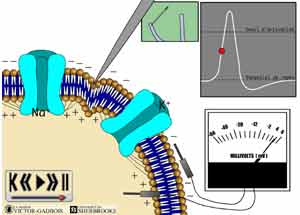
À l'état normal, toute cellule vivante est porteuse d'une charge électrique qui est différente de la charge électrique présente dans son environnement. Cette différence entre ces deux charges électriques, intra et extra cellulaire, peut être mesurée par un voltmètre. A l'état normal, cette lecture indique une charge positive pour l'environnement extra-cellulaire et une charge négative pour l'intérieur de la cellule. Cette différence de charges électriques s'observe de part et d'autre de la membrane cellulaire qui sépare, dans les faits, les milieux extra et intra cellulaires.
Cette différence de charges électriques se définit comme étant une polarisation, on dit alors que la membrane cellulaire (neuronale ou axonale dans le cas présent) est polarisée. Cette polarisation concerne classiquement deux électrolytes, le sodium (Na+) et le potassium (K+). Le Ca++ et le Cl- jouent aussi un rôle mais plus tardivement dans la génération d'un influx. La polarisation s'explique par le fait que la concentration en ions sodiques, Na+, est plus élevée à l'extérieur de la cellule qu'à l'intérieur de celle-ci. Les ions potassiques, K+, se retrouvent en plus grande concentration à l'intérieur de la cellule qu'à l'extérieur mais ne font pas le contrepoids avec les ions Na+ pour ce qui concerne les charges électriques étant donnée l'importante différence quantitative en faveur des ions Na+.
En situation de repos, la polarisation i.e. le potentiel de repos, découlant de la différence de charge ionique de part et d'autre de la membrane neuronale s'exprime en millivolts (mV). Comme la charge intérieure est négative, la polarisation est exprimée en valeur négative. Par exemple, il est ainsi fréquent de rencontrer des charges de - 40 mV à - 60 mV (moins 40 à moins 60 mV) pour une cellule.
Quant survient une stimulation des nocicepteurs (ou de toute structure neuronale: axone, dendrite), on observe alors une augmentation de la perméabilité de la membrane neuronale dans la région de la stimulation. Les ions sodiques Na+ qui se trouvent en abondance à l'extérieur de la cellule commencent à se déverser à l'intérieur de la cellule par des ouvertures déjà toutes créées dans les membranes cellulaires mais qui sont fermées en situation de repos i.e. lors du potentiel de repos. Ces ouvertures correspondent à des structures anatomiques spécifiques auxquelles on réfère sous le nom de "canaux ioniques" (Voir: LES DIFFERENTS "CANAUX IONIQUES"). Ce phénomène s'accompagne en même temps d'un certain mouvement des ions potassiques K+ qui sont alors évacués vers l'extérieur de la cellule par le biais de certains canaux ioniques spécifiques K+. Les charges électriques de part et d'autre de la membrane cellulaire connaissent dès lors une inversion au point où les charges négatives tendent à se positiver, à titre d'exemple les charges auront tendance à évoluer vers -30, -12, -4, + 6. Ce phénomène d'inversion des charges porte de nom de "dépolarisation". L'ouverture rapide de certains canaux ioniques spécifiques K+est là pour protéger au début de toute stimulation dont l'intensité pourrait être nociceptive afin que la dépolarisation ne se produise pas trop rapidement.
ANIMATION 25.1
Lorsque la dépolarisation commence à se produire, l'influx nociceptif n'est pas encore créé. Il faudra que la dépolarisation atteigne un certain voltage transmembranaire pour que d'autres canaux inoniques Na+ (les canaux voltage dépendants) différents des premiers et tout particulièrement les canaux Ca++ s'ouvrent soudainement afin de laisser entrer une quantité élevée d'ions Na+ et Ca++ qui s'ajouteront aux ions Na+ déjà présents, ce qui aura pour effet de créer enfin le potentiel d'action i.e. l'influx nociceptif.
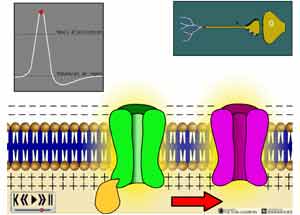
ANIMATION 25.2 La valeur du voltage transmembranaire devant être atteint pour provoquer l'ouverture des canaux "voltage dépendants" correspond au "seuil d'activation". Il est important de noter que le seuil d'activation n'est pas fixe pour une terminaison nociceptive donnée, cette valeur du seuil d'activation peut augmenter ou diminuer selon certaines circonstances et selon l'environnement biochimique dans lequel les nocicepteurs se trouvent suite à certaines stimulations nociceptives (coup de soleil vs oedème par entorse).
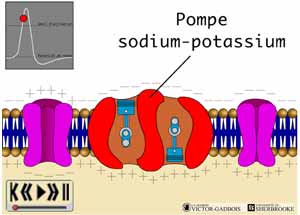
Après la création d'un influx, les canaux Na+ et Ca++ se referment rapidement, les pompes Na-K s'activent de façon plus importante pour retourner le Na+ vers l'extérieur de la cellule et du K+ vers l'intérieur (3 Na+ pour 2 K+) et en même temps, certains canaux K+ spécifiques à la repolarisation et différents des premiers s'ouvrent de façon transitoire pour permettre au K+ de revenir à l'intérieur de la cellule. Cet ensemble de processus vise à rétablir rapidement le potentiel transmembranaire de repos. C'est le phénomène de repolarisation.
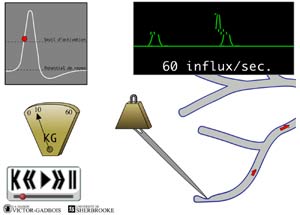
ANIMATION 25.3 Dans le cas des nocicepteurs, la stimulation nociceptive soutenue entrainera un train d'influx nociceptif à une fréquence donnée. En fait, les nocicepteurs ont cette double capacité d'adapter leur seuil d'activation à l'intensité du stimulus nociceptif et d'adapter ainsi leur fréquence de décharges (firing rate) à l'intensité du stimulus nociceptif bien que cette capacité soit beaucoup plus lente que celle des récepteurs non nociceptifs (fuseaux musculaires (muscle spindles), organes tendineux de Golgi (Golgi tendon organ), récepteurs spécialisés dans les tendons, les ligaments et les articulations, corpuscules de Pacini (Pacinian corpuscles), corpuscules de Meissner (Meissner's corpuscles), corpuscules de Ruffini et disques de Merkel). Ainsi, à une certaine intensité de stimulus, tel neurone nociceptif produira 60 influx par secondes alors qu'à six fois cette intensité, le même neurone produira plus d'influx mais l'augmentation n'aura pas été proportionnelle, il ne produira, à titre d'exemple, que 100 influx par secondes. Le seuil d'activation pour créer un seul influx et celui pour créer une salve de 100 influx par secondes n'est pas le même, il s'est élevé considérablement dans le second cas sinon, l'augmentation aurait été proportionnelle.
ANIMATION 25.4 Dans le cas des fibres dont les terminaisons sont munies de nocicepteurs, l'influx ou le courant électrique ainsi créé transporte une information qui sera interprétée par le cerveau comme un message douloureux. On réfère à ce type de fibres comme étant des "fibres nociceptives" et on appelle ce type de transmission orientée vers le cerveau une "afférence" nociceptive. En contrepartie, les fibres motrices sont des "efférences".
26 - Les différents "canaux ioniques"
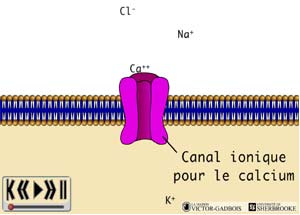
Plusieurs types de "canaux ioniques" existent, les quatre principaux sont les canaux:
- sodiques (Na+),
- potassiques (K+),
- chloriques (Cl-)
et- calciques (Ca++).
Certains canaux sont spécifiques pour un ion donné mais plusieurs canaux permettent le passage de plus d'une sorte d'ion.
ANIMATION 26.1
Les "canaux sodiques" et les "canaux calciques" jouent un rôle majeur dans les phénomènes de dépolarisation membranaire.
Les canaux ioniques répondent i.e. vont s'ouvrir pour laisser passer des ions à la suite de trois types de stimulation:
- une stimulation "mécanique" qui a comme effet d'entrainer l'ouverture de certains canaux suite à l'étirement de la membrane. Ce sont les canaux "tension dépendants" [stretch activated]. La base de ces canaux est attachée au cytosquelette (à la membrane cellulaire) par des fines microfibrilles qui se comportent un peu comme les cordes de parachute qui lors de la mise en tension permettent au parachute de s'ouvrir, la mise sous tension de ces microfibrilles suite à l'étirement membranaire provoque l'ouverture de ces canaux,
- une stimulation "chimique" qui peut provenir d'un neurotransmetteur, d'un médicament (Voir: LA CORNE POSTERIEURE: UNE "COUR DE TRIAGE" COMPLEXE) ou encore d'une substance intracellulaire. Ce sont les canaux "médiateurs dépendants".
- une stimulation "électrique" qui correspond en fait à l'atteinte d'un certain voltage transmembranaire dans leur voisinage immédiat. Ce sont les canaux "voltage dépendants". Ces canaux vont "attendre" qu'un certain voltage transmembranaire qui leur est spécifique ait été atteint avant de s'ouvrir. L'atteinte de "ce certain voltage transmembranaire" découle de l'ouverture au préalable d'un certain nombre de canaux ioniques "médiateurs dépendants".
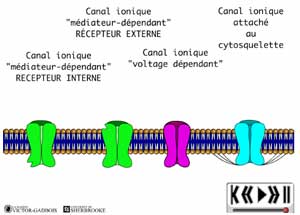
ANIMATION 26.2
A la différence des autres canaux ioniques, les canaux "voltage dépendants", lorsqu'ils s'ouvrent, permettent habituellement une entrée ou une sortie massive d'ions. Dans bon nombre de cas, la valeur de ce voltage transmembranaire spécifique correspond au seuil d'activation i.e. à la valeur du potentiel transmembranaire qui perment la création d'un influx électrique.La différence de concentration d'un bord et de l'autre de la membrane cellulaire fixe la contribution que chaque ion peut apporter dans l'accentuation ou la réduction du potentiel transmembranaire. Ainsi selon le type de cellule:
- l'ion Na+ peut contribuer pour + 40 à + 60 mV,
- l'ion Ca++ peut contribuer pour + 60 à + 240 mV,
- l'ion K+ peut contribuer pour - 80 mV,
alors que- l'ion Cl- peut contribuer tout au plus pour - 20 à - 60 mV.
C'est donc dire combien les canaux sodiques et calciques sont importants dans la production des influx de tout type.
Il existe aussi une autre forme de canaux ioniques qui a comme particularité de fonctionner à l'envers des canaux ioniques, ce sont les pompes Na-K. A l'inverse des canaux ioniques, les pompes Na-K travaillent à contre-courant en retournant de façon continue les ions là où ils sont en plus grande concentration donc en maintenant des concentrations inégales d'ions de part et d'autre de la membrane cellulaire et en participant aux mécanismes de repolarisation. Les pompes Na-K sont en fait des canaux ioniques particuliers fonctionnant à très haute consommation d'énergie. Dans les neurones excitables, jusqu'à 70% de l'énergie cellulaire est utilisé par la pompe Na-K qui est en fait un enzyme de type ATPase pour créer et maintenir une concentration très inégale des ions Na+ et K+ à travers la membrane cellulaire. Les pompes retournent plus de Na+ vers l'extérieur de la cellule que de K+ vers l'intérieur (3 Na+ pour 2 K+) c'est ce qui engendre le potentiel transmembranaire de repos et la charge négative intracellulaire puisque beaucoup plus d'ions Na+ se retrouvent à l'extérieur qu'à l'intérieur de la cellule.
27 - Le phénomène d'hyperpolarisation "membranaire"
Certaines situations particulières peuvent faire en sorte qu'une cellule subisse une augmentation de sa charge négative au lieu d'une réduction (dépolarisation), on dit alors qu'elle est hyperpolarisée. En situation d'hyperpolarisation, le gradient de voltage transmembranaire devient plus important que lors du potentiel de repos, il peut ainsi devenir - 65 mV par exemple alors qu'il était - 40 mV au repos.
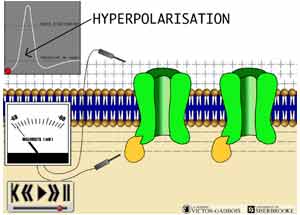
ANIMATION 27.1
Le phénomène d'hyperpolarisation provient pour sa part d'une ouverture des canaux chloriques (Cl-) et des canaux potassiques (K+) de façon concomitante. L'ouverture des canaux chloriques (Cl-) entraîne une migration des ions Cl- vers l'intérieur de la cellule, ce qui a pour effet d'accentuer la charge négative intracellulaire. Cette accentuation n'est pas très importante étant donné la faible contribution que l'ion Cl- peut offrir à ce titre. En même temps, l'ouverture des canaux potassiques (K+) permet au K+ de migrer vers l'extérieur ce qui vient encore accentuer la charge négative intracellulaire et donc l'hyperpolarisation. La contribution des ions K+ est plus importante que celle des ions Cl-.
L'hyperpolarisation joue un rôle particulier dans deux situations tout particulièrement:
- lors du phénomène de repolarisation alors que les canaux K+ spécifiques à la repolarisation peuvent demeurer ouverts de façon prolongée provoquant ainsi une période réfractaire post activation ce qui a pour effet de retarder la génération du prochain influx,
- lors de l'usage des opiacés qui ont pour effet d'entrainer l'ouverture de certains canaux K+ spécifiques. Cette ouverture provoque alors une hyperpolarisation régionale de la membrane réduisant ainsi considérablement les chances que le seuil d'activation ne soit atteint lorsqu'un influx nociceptif arrivera dans cette région puisque la valeur du voltage transmembranaire se trouve donc encore plus "négativée". (Voir: LA TRANSMISSION D'UN INFLUX DANS L'ESPACE SYNAPTIQUE: LES NTs "INHIBITEURS", L'HYPERPOLARISATION ET LES EFFETS SUR LE BOUTON PRE-SYNAPTIQUE ET LE NEURONE CENTRAL / LES RECEPTEURS OPIACES CENTRAUX: LES EFFETS PRODUITS PAR LEUR STIMULATION AU NIVEAU MEDULLAIRE)
28 - Le phénomène de sensibilisation
Deux caractéristiques électrophysiologiques très particulières des nocicepteurs ont été discutés jusqu'à maintenant:
- un seuil de dépolarisation élevé pour les stimuli naturels en comparaison des autres types de récepteurs dans le même milieu. Ceci fait en sorte que les stimuli normaux i.e. "non douloureux" comme le fait de toucher la peau ne puisse pas provoquer de douleur en temps normal. Cette caractéristique découle de la participation de certains canaux K+ spécifiques et du seuil d'activation relativement élevé des nocicepteurs,
- une tendance à augmenter leur fréquence d'influx suite à un stimulus douloureux prolongé i.e. produire de plus en plus d'influx douloureux en contexte de situations "agressantes" particulières sans pour autant le faire de façon proportionnelle (Voir: LE PHENOMENE DE DEPOLARISATION "MEMBRANAIRE" ET LE SEUIL D'ACTIVATION). Deux de ces circonstances "agressantes" sont connues depuis longtemps en recherche clinique
- les stimuli répétitifs
- les stimuli de plus en plus élevés en intensité.
C'est donc dire que les nocicepteurs prennent un certain temps avant de commencer à réagir mais qu'une fois la production d'influx débutée, ils ont la capacité d'augmenter leur fréquence d'activation suite à des stimuli répétitifs ou suite à des stimuli de plus en plus intenses.
En fait, les nocicepteurs savent faire preuve d'adaptation mais d'une adaptation qui n'est pas toujours au bénéfice de la personne qui a mal. Ainsi, les nocicepteurs peuvent voir leur seuil d'activation s'abaisser pour la peine en certaines situations rendant du même coup leur activation plus facile. Dans ces circonstances, même leur réponse en terme de fréquence d'influx peut se trouver en même temps augmentée. Cet abaissement du seuil d'activation peut même conduire à ce qui semble être une activité spontanée i.e. une activation spontanée, donc à la création d'influx nociceptif spontanés sans stimulations douloureuses évidentes.
ANIMATION 28.1
Cet ensemble de phénomènes porte le nom de "sensibilisation" et sera illustré plus loin sur la base des mécanismes inflammatoires menant à la présence des substances "algogènes" dans les régions "lésées". (Voir: L'ACTIVATION "PRIMAIRE": ACTIVATION ET SENSIBILISATION DES NOCICEPTEURS)
La fatigue chez les humains joue un peu ce rôle de sensibilisation puisqu'alors l'intolérance, les sauts d'humeur, les colères impulsives sont à risque d'éclater au moindre stimulus irritatif qui survient. Le phénomène de sensibilisation ne s'arrête donc pas avec les nocicepteurs! On dit alors que le seuil de tolérance est abaissé et quand la colère éclate, elle est souvent d'intensité et de durée au-delà de la norme usuelle, il en est ainsi pour les nocicepteurs.
Dans d'autres circonstances, suite à des stimuli répétitifs de plus en plus élevés en intensité, l'adaptation se fera par une élévation considérable du seuil d'activation. Il faudra alors des stimuli nociceptifs beaucoup plus intenses qu'à l'habitude (suprathreshold stimuli) pour atteindre le nouveau seuil d'activation. Les conséquences cliniques de ces changements seront néfastes de nouveau pour la personne qui a mal (Voir: HYPERPATHIE DANS: UN LEXIQUE "DOULOUREUX" ). On ne parlera pas alors de sensibilisation mais d'adaptation des nocicepteurs.
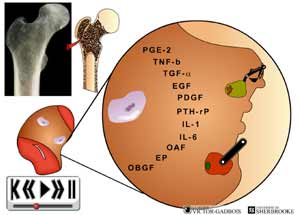
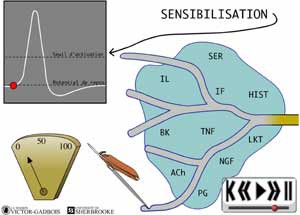
29 - Le caractère "agressant" des différents stimuli "douloureux" et la production de substances inflammatoires
30 - L'activation "primaire"
Les premiers influx nociceptifs apparus à la suite de l'événement agressant commencent alors à se propager dans les fibres nociceptives. Une très large portion de ces influx se déplace "vers le cerveau" i.e. dans une direction "dromique" et la douleur commence alors à être ressentie, l'activation primaire des nocicepteurs a ainsi eu lieu.
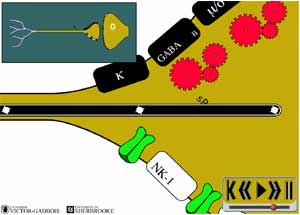
Cependant, après avoir cheminé dans la fibre nociceptive dans la direction "dromique" i..e dans la direction attendue, une portion des premiers influx nociceptifs ainsi créée par l'événement agressant change de direction. Ces influx "inversés" se dirigent alors vers les premiers sites d'embranchements des terminaisons nerveuses pour se rendre finalement jusqu'à la complète périphérie i.e. vers la partie la plus distale des terminaisons où ils viennent se terminer, on parle alors d'une orientation "antidromique".
Ces influx "antidromiques" provoquent
- la migration de vésicules de substances P vers les extrémités périphériques des terminaisons nerveuses "nociceptives"
- la libération de substance P dans les tissus environnants.
ANIMATION 30.1 Cette substance, contenue dans de fines vésicules au niveau des terminaisons nerveuses fait l'objet d'un transport actif dans les fibres nociceptives puisqu'on son site de production se trouve à l'autre bout de la fibre nociceptive, là où se trouve le noyau des neurones nociceptifs, où elle joue encore un rôle important dans le relais des influx nociceptifs entre les deux fibres nociceptives périphériques et centrales. (Voir: LA CORNE POSTERIEURE: UNE "COUR DE TRIAGE" COMPLEXE).
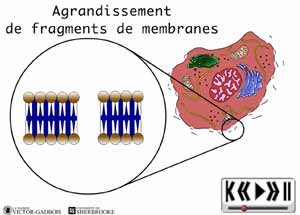
ANIMATION 30.2 Dès leur production, les prostaglandines augmentent de façon considérable la sensibilité des différentes terminaisons nerveuses à la bradykinine. En peu de temps, les autres substances inflammatoires dites "algogènes" commencent déjà à s'accumuler.
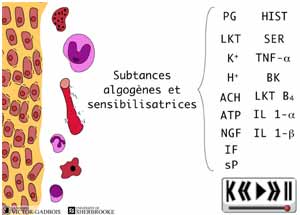
ANIMATION 30.3 En peu de temps, se retrouvent donc, dans un même environnement, une "redoutable" famille de substances inflammatoires "algogènes" parmi lesquelles figurent tout particulièrement:
31 - L'activation "primaire": Activation et sensibilisation des nocicepteurs
Ces substances inflammatoires "algogènes" agissent de différentes façons, elles peuvent
- produire une stimulation directe des nocicepteurs, c'est-à-dire une "activation" des nocicepteurs qui correspond en fait à produire le cycle complet de dépolarisation jusqu'à l'atteinte du seuil d'activation pour créer des influx nocicepteurs,
ou- sensibiliser les nocicepteurs, i.e. provoquer un abaissement du seuil d'activation des nocicepteurs ce qui vient ainsi faciliter leur activation à la suite d'un stimulus quelconque. Un plus faible stimulus est alors nécessaire pour franchir le seuil de potentiel transmembranaire nécessaire pour déclencher un influx douloureux et l'effet des différentes substances "algogènes" (K+, bradykinine, sérotonine, histamine, acétylcholine) se trouve ainsi grandement facilité.
Les prostaglandines et la substance P
- n'entraînent pas directement d'activation des nocicepteurs i.e. elles ne peuvent à elles seules provoquer la création d'influx nociceptifs,
- elles ont cependant pour effet de sensibiliser les nocicepteurs à toute stimulation douloureuse et de faciliter ainsi l'activation des nocicepteurs sensibilisés.
Les autres substances "algogènes" (K+, bradykinine, sérotonine, histamine, acétylcholine), pour leur part, "activent" directement les nocicepteurs.
Sensibilisation et activation sont donc deux phénomènes complémentaires qui prennent place au niveau des nocicepteurs dans les régions où les stimuli douloureux ont lieu.
32 - L'activation "secondaire"
La présence de substances inflammatoires "algogènes" de plus en plus nombreuses au pourtour des nocicepteurs permet "d'activer" de plus en plus facilement les nocicepteurs, ce qui accentue encore plus le relâchement antidromique de substance P à partir des terminaisons nerveuses des fibres nociceptives.
La substance P concourt à plusieurs effets pour accentuer son action "algogène", elle agit sur 4 structures:
-
les capillaires locaux
-
elle augmente de façon considérable la perméabilité vasculaire, ce qui entraîne un oedème local et facilite encore plus l'accumulation de bradykinine en provenance des capillaires dilatés i.e. d'origine vasculaire
-
elle augmente de façon considérable la perméabilité vasculaire, ce qui entraîne un oedème local et facilite encore plus l'accumulation de bradykinine en provenance des capillaires dilatés i.e. d'origine vasculaire
-
les plaquettes
-
elle entraîne le largage de sérotonine à partir des plaquettes
-
elle entraîne le largage de sérotonine à partir des plaquettes
-
les mastocytes
- elle entraîne le largage d'histamine à partir des mastocytes
-
les terminaisons axonales elles-mêmes
- elle augmente de façon considérable l'oedème axonal.
L'augmentation de la perméabilité capillaire augmente la diffusion des substances algogènes d'origine vasculaire qui s'ajoute alors aux substances algogènes déjà produites localement par l'activité inflammatoire focale. Plus ces différentes substances s'accumulent, plus l'oedème se propage, plus le jeu de la sensibilisation et de l'activation des nocicepteurs s'étend en surface et plus la "zone douloureuse" s'agrandit. On réfère à ce phénomène d'élargissement de la zone douloureuse en terme "d'activation secondaire".
Le phénomène du cercle vicieux trouve alors sa véritable manière d'être. Plus la sensibilisation augmente, plus le nombre de nocicepteurs activés s'accentue, plus le nombre de nocicepteurs activés s'accentue, plus il y a de substance P libérée, plus il y a de substance P libérée et plus la concentration des nombreuses substances algogènes augmente, plus la concentration des nombreuses substances algogènes augmente, plus la sensibilisation des nocicepteurs augmente, plus la sensibilisation des nocicepteurs augmente, plus le nombre d'activation ... et le cercle vicieux se propage.
Plus le cercle vicieux se propage, plus le nombre d'influx nociceptif augmente; plus le nombre d'influx nociceptif augmente, plus le réseau nociceptif est sollicité; plus le réseau nociceptif est sollicité, plus le système de relais ou de transmission des influx nociceptifs est occupé à son tour. Plus le cercle vicieux se propage, plus la zone de douleur s'agrandit. Cette zone peut parfois prendre des proportions étonnantes.
33 - Le système "sympathique" ...qu'il ne fallait pas oublier!
Il ne faut surtout pas oublier, à travers toute cette cascade de réactions biochimiques, la présence et l'implication du système nerveux autonome sympathique (SNAS) (Voir: LA DOULEUR NOCICEPTIVE VISCERALE: SON PARCOURS DANS LE CIRCUIT NERVEUX AUTONOME). Le SNAS est intensément présent par ses terminaisons nerveuses en grand nombre au pourtour des vaisseaux sanguins et des nocicepteurs et les terminaisons du SNAS libèrent de la norépinéphrine (NE).
L'accumulation des substances algogènes dans l'environnement des terminaisons nerveuses du SNAS a pour effet d'activer ces mêmes terminaisons à libérer la norépinéphrine contenues dans ses terminaisons.
Par ailleurs, les influx nociceptifs alors créés par les stimuli douloureux et par les substances algonènes "sensibilisatrices et activatrices", activent, à l'étage médullaire où ils font leur entrée, des interneurones qui sont connectés avec les fibres préganglionnaires du SNAS. Le résultat est alors l'équivalent d'une activation par le centre de contrôle hypothalamique, les fibres préganglionnaires sont alors activées par les fibres nociceptives; elles deviennent donc sous double contrôle, hypothalamique et nociceptif. Les fibres préganglionnaires une fois activée par les interneurones font relais avec les fibres postganglionnaires qui sont connectées par leurs terminaisons avec les vaisseaux sanguins et les nocicepteurs. Encore plus de norépinéphrine contenues dans ces terminaisons est libérée.
Les terminaisons nerveuses du SNAS se trouvent ainsi "doublement" activées avec comme conséquence que de la norépinéphrine (NE) se retrouve en grande abondance au pourtour des capillaires, des nocicepteurs tissulaires et des nocicepteurs capillaires car il existe des nocicepteurs au niveau des vaisseaux sanguins (Voir: LES NOCICEPTEURS: LEURS LOCALISATIONS).
Cet important déversement de NE concourt à activer encore plus les nocicepteurs et à activer encore plus de nocicepteurs et donc à provoquer encore plus de douleurs. Sans compter qu'un effet vasoconstricteur, au début subtil, s'exerce déjà avec les conséquences ultérieures possibles de douleurs régionales complexes avec participation du SNAS.
Cette augmentation de catécholamines (NE) a aussi pour effet d'augmenter encore plus la sensibilité des nocicepteurs aux stimulations douloureuses et aux substances chimiques algogènes présentes. Le phénomène de "sensibilisation" connait ainsi un étrange effet d'amplification pour ne pas dire d'autoamplification et ces effets d'amplification dépendent donc de multiples facteurs agissant en synergie.
34 - L'impressionnante cascade de relais dans la transmission de l'influx douloureux
A la suite d'une stimulation douloureuse, un courant électrique "nociceptif" naît ainsi de l'effet combiné de la sensibilisation et de l'activation des nocicepteurs, cela dans un environnement où se joue un processus inflammatoire fort complexe. Ce courant électrique, porteur d'influx nociceptifs, se propage dans les fibres du réseau nociceptif, les fibres nociceptives.
A chaque fois que naissent des influx nociceptifs, et cela peu importe d'où elles originent, s'ensuit une cascade impressionnante de relais dans la transmission des signaux douloureux avant qu'ils n'aboutissent finalement au cerveau où ils seront identifiés comme stimuli douloureux.
Qu'en est-il donc de cette cascade impressionnante de relais dans la transmission des signaux douloureux mieux désignés par le vocable "afférences nociceptives"? Cette cascade est relativement complexe, mais son explicitation ouvre à une meilleure compréhension
35 - Le système de transport des influx nociceptifs: les fibres nerveuses ou neurones
Il existe dans le réseau nerveux, différents types de fibres avec différentes fonctions. Ces fibres sont des cellules nerveuses dont la caractéristique anatomique est de s'étendre sous la forme de "fins prolongements filamenteux" au lieu d'être de forme ronde comme une bonne majorité de cellules des tissus autres que le tissu nerveux. La cellule nerveuse s'appelle un neurone.
Le neurone est l'unité anatomique et fonctionnelle du système nerveux. Il est entouré d'une membrane cellulaire appelé membrane neuronale. L'influx électrique observé dans un neurone est en fait véhiculé au niveau de la membrane neuronale.
Il existe, au niveau des neurones nociceptifs, deux grandes divisions anatomiques:
- les neurones périphériques, qui partent des différentes structures où existent des nocicepteurs et qui transportent les influx douloureux jusqu'à la moelle
et
- les neurones centraux, qui transportent les influx douloureux à l'intérieur de la moelle et du cerveau jusqu'à leur point de réception et "d'interprétation".
Les neurones nociceptifs périphériques diffèrent des neurones nociceptifs centraux à certains égards.
36 - Le système de transport des influx nociceptifs: les neurones centraux et périphériques
Les neurones nociceptifs centraux sont formés:
- d'un corps cellulaire contenant le noyau cellulaire et qui se trouve au début de la fibre afférente,
- de multiples arborisations toutes très courtes disposées au pourtour du corps cellulaire (les dendrites),
- d'un seul long prolongement cylindrique (l'axone) de longueur variable selon le cas à l'autre extrémité du corps cellulaire i.e. à l'extrémité plus centrale. A partir de l'unique axone originant du corps cellulaire, ce long prolongement peut se terminer en fibre unique au moment de sa connexion avec une structure spécifique mais il peut aussi se terminer à sa portion la plus distale en un certain nombre de fins prolongements axonaux "filamenteux" de longueur variable selon les structures à rejoindre. Ces fins prolongements peuvent prendre l'allure d'embranchements multiples lorsqu'ils ont comme fonction d'assurer les nombreuses connexions multiétagées comme ce que l'on observe dans le cas des réseaux ascendants polysynaptiques (pex. paléospinothalamique).
Les neurones nociceptifs périphériques sont formés pour leur part:
- d'un corps cellulaire contenant le noyau cellulaire qui se trouve presque à la toute fin de la fibre afférente. de la fibre afférente. L'ensemble des corps cellulaires forme le renflement observable dans la racine postérieure au niveau du trou de conjugaison, ce renflement porte le nom de "ganglion spinal". A partir du corps cellulaire, le neurone nociceptif périphérique se divise rapidement en deux directions opposées: un prolongement vers la moelle et un prolongement vers la périphérie,
- d'un prolongement axonal vers la moelle et qui se rend jusqu'à la corne postérieure où il se termine. Ce prolongement forme en fait la racine à la hauteur du trou de conjugaison. Par la suite, il se termine en plusieurs arborisations qui vont faire connexions (synapse) sur les neurones centraux,
- d'un prolongement axonal vers la périphérie i.e. vers la structure innervée. Ce prolongement une fois arrivé dans la structure périphérique innervée, se ramifie à son tour habituellement en plusieurs "prolongements filamenteux". Ces fins prolongements axonaux "filamenteux" prennent l'allure d'embranchements multiples qui vont former tous ensemble finalement un nocicepteur.
37 - Les fibre nerveuses ou neurones: les différentes espèces anatomiques
Chaque fibre nerveuse peut être identifiée par trois paramètres:
- la taille, i.e. le diamètre
- la vitesse de conduction
et- la présence ou non d'un recouvrement de myéline et l'importance de ce recouvrement.
Six types de fibres sont ainsi décrites:
- A alpha (A
) - (motrices et sensorielles), aussi appelées Ia et Ib lorsqu'elles originent de structures musculaires ou articulaires, elles sont les plus grosses, les plus rapides et sont pourvues d'un abondant recouvrement de myéline. Elles sont connectées à des terminaisons spécialisées: fuseaux musculaires (muscle spindles), organes tendineux de Golgi (Golgi tendon organ), récepteurs spécialisés dans les tendons, les ligaments et les articulations. Ces terminaisons offrent les informations de nature kinesthésique sur: le degré d'étirement musculaire, l'angle de positionnement d'une articulation, le mouvement et la rapidité de mouvement d'une articulation.
- A bêta (A
) - (motrices et sensorielles), aussi appelées II lorsqu'elles originent de structures musculaires ou articulaires, elles sont assez grosses, passablement rapides et sont pourvues d'un recouvrement de myéline un peu moindre que les A alpha. Elles sont connectées à des terminaisons spécialisées qui sont encapsulées: corpuscules de Pacini (Pacinian corpuscles) - (vibration), corpuscules de Meissner (Meissner's corpuscles) - (toucher superficiel complexe), corpuscules de Ruffini et disques de Merkel. Ces terminaisons offrent les informations sur la stimulation cutanée complexe: les stimulations cutanées vibratiles (sens de la vibration), la discrimination tactile (discrimination deux points), la discrimination tactile complexe discriminative (par exemple identifier une pièce de monnaie dans la main), le sens de la position, le sens de vibration, le degré de pression subi par la surface cutanée.
- A gamma (A
) - (motrices seulement) elles sont un peu moins grosses, un peu moins rapides et pourvues d'un recouvrement de myéline un peu moins abondant que les A bêta.
- A delta (A
) - (sensorielles seulement), aussi appelées groupe III lorsqu'elles originent de structures musculaires ou articulaires, elles sont d'un diamètre plus petit que les autres A. Elles ne sont recouvertes que d'une fine couche de myéline et sont donc plus lentes que les trois autres A. Elles sont connectées à des terminaisons libres i.e. sans structures particulières en comparaison des terminaisons des fibres A alpha et A bêta. Les terminaisons libres connectées aux fibres A delta offrent les informations sur: le toucher léger superficiel, la stimulation thermique froide non douloureuse (terminaisons libres thermosensibles i.e. à faible seuil d'activation) et sur la douleur aiguë rapide de type "piqûre" (terminaisons libres nociceptives répondant à des stimulations à bas seuil d'activation mais capable de répondre à des seuils plus élevés: thermiques, mécaniques, chimiques). Elles sont aussi connectées à des terminaisons libres nociceptives ne répondant qu'aux stimulations à haut seuil d'activation [récepteurs polymodaux]: thermiques, mécaniques, chimiques). En fait la majorité des A delta est connecté à des récepteurs polymodaux.
- B - (motrices seulement) elles sont d'un diamètre encore un peu plus petit que celui de la A delta, elles sont recouvertes d'une plus fine couche de myéline que toutes les A et sont donc plus lentes que les A.
et
- C - (motrice et sensorielle) elles sont les plus petites de toutes les fibres nerveuses, elles sont dépourvues de tout recouvrement de myéline et sont donc très lentes de conduction, les plus lentes de toutes les fibres en fait. Elles sont appelées groupe IV lorsqu'elles originent de structures musculaires ou articulaires. Les fibres C dominent très largement comme population. Elles représentent en fait la très large majorité des afférences cutanées, entre 60-90 % de toutes les afférences cutanées et représentent de plus la presque totalité de toutes les afférences viscérales. Elles sont connectées à des terminaisons libres i.e. sans structures particulières en tout point identiques à celles des fibres A delta. Les terminaisons libres connectées aux fibres C offrent les informations sur: la stimulation thermique chaude non douloureuse (terminaisons libres thermosensibles i.e. à faible seuil d'activation) et sur la douleur aiguë "tardive ... de quelques secondes après l'information des A delta" de type "brulûre"(terminaisons libres nociceptives ne répondant qu'aux stimulations à haut seuil d'activation [récepteurs polymodaux]: thermiques, mécaniques, chimiques). L'immense majorité des fibres C est connectée à des récepteurs polymodaux.
Les axones des fibres A alpha, A bêta, A gamma et A delta du système nerveux central sont enveloppées d'une gaine de myéline qui est formée par une des cellules du SNC, les oligodendrocytes. Pour leur part, les axones des fibres A alpha, A bêta, A gamma et A delta et B du système nerveux périphérique sont enveloppées d'une gaine de myéline qui est formée par les cellules de Schwann, équivalent périphérique des oligodendrocytes centraux.
38 - Les fibres nerveuses "nociceptives": les fibres C et A Delta et leur fonction
Quand les nocicepteurs ont été activés, les influx électriques sont alors transportés vers le cerveau par les fins prolongements "filamenteux" axonaux, les fibres nociceptives. Le réseau nociceptif est constitué principalement de deux types de fibres nerveuses:
-
les fibres A delta
Ces fibres sont d'un diamètre un peu plus grand que les fibres C, elles sont recouvertes d'une mince couche de myéline. En partie en raison de l'isolant myélinisé, elles conduisent les influx plus rapidement ( 12 - 30 m/s) que les fibres C. Les fibres A delta originent pour la plupart des différents nocicepteurs autres que polymodaux.et
-
les fibres C
Ces fibres sont extrêmement fines et de conduction lente (environ 1 m/s), elles ne possèdent pas "d'isolant" de myéline à leur pourtour. Elles ne sont donc pas myélinisées. La plupart des fibres C originent des récepteurs polymodaux.
-
-
La douleur transportée par les fibres C est susceptible de devenir rapidement "intolérable", elle est diffuse et imprécise dans sa localisation et ressentie comme une brulûre ou un élancement.
-
La différence dans la vitesse de conduction explique pour une bonne part les deux étapes séquentielles qu'il nous est possible d'observer lorsque nous éprouvons de la douleur à la suite d'un stimulus douloureux relativement intense.
-
La première douleur: ainsi, par exemple, lorsqu'on se fait une incision "accidentelle" avec un objet tranchant, lorsqu'on met le pied sur une aiguille ou un clou, lorsqu'on se frappe un doigt avec un marteau on ressent une douleur "immédiate". Le temps de perception de cette première doulour est estimé, en laboratoire, à environ 200 millisecondes. Cette première douleur est le plus souvent définie comme une piqûre. Elle est bien localisée, est apparue extrêmement rapidement après le stimulus. Cette douleur aiguë provient du réseau nociceptif des fibres A delta. Elle a servi à ce qu'elle est censée servir: nous aviser par un signal non équivoque d'une agression qui pourrait même devenir plus importante. Des réflexes vifs se sont exercés pour en éliminer la cause ... si possible et pour en réduire les conséquences. Voilà l'expression du circuit nociceptif dans sa plus simple expression.
- La deuxième douleur: quelques secondes plus tard, environ 2 à 3 secondes, la douleur transportée par les fibres C, la deuxième douleur (la véritable, la tenace!) apparaît , celle-ci est beaucoup plus intense et incommodante et elle devient rapidement plus diffuse. Cette deuxième douleur est souvent ressentie comme une sensation de brûlure et/ou d'un élancement, elle est ressentie sur une surface beaucoup plus étendue que la première et il devient rapidement difficile de différencier ou de localiser l'endroit précis du traumatisme dans la zone élargie et diffuse où la douleur est ressentie (les informations proprioceptives que les fibres A delta fournissaient sont perdues parmi la dominance d'influx conduites par les fibres C "non proprioceptives"). Cette deuxième douleur nous fait "regretter" le traumatisme subi pendant souvent plusieurs jours! C'est ici que l'environnement inflammatoire des substances algogènes exerce tous ses méfaits.
Les fibres A delta véhiculent les influx nociceptifs en provenance des nocicepteurs:
- mécanorécepteurs
- thermorécepteurs
-
mécanothermiques.
Elles sont donc "branchées" avec ces différents récepteurs.
Les fibres C véhiculent les influx nociceptifs en provenance des nocicepteurs:
- mécanothermiques
-
récepteurs polymodaux.
Elles sont donc "branchées" avec ces différents récepteurs.
Les quatre autres types de fibres, les fibres
- A alpha
- A bêta
- A gamma
- B
n'ont pas comme fonction de transporter des influx nociceptifs. Les A alpha et A bêta transportent cependant des informations sensorielles (tactiles et proprioceptives
39 - Le système de transport des influx nociceptifs: l'architecture périphérique
La première série d'axones, à partir des nocicepteurs, s'appellent les axones périphériques. Ces axones périphériques se regroupent pour devenir des nerfs, qui, se regroupant, deviennent des plexus. Sur leur trajet afférent, ces fibres, toujours en périphérie, se regroupent ensuite pour devenir des racines. C'est par les racines postérieures finalement que les influx nociceptifs font "classiquement" leur entrée dans la moelle. Alors que la majorité des fibres nociceptives pénètrent dans la moelle par la racine postérieure pour aller terminer immédiatement à leur entrée i.e. en ipsilatéral, un certain nombre de fibres nociceptives C font exception et font leur entrée par les racines antérieures pour se diriger elles aussi dans la corne postérieure ipsilatérale.
A l'intérieur des nerfs, des plexus et de la partie "périphérique" des racines i.e. avant d'entrer par les trous de conjugaison, les fibres nociceptives tout comme les autres fibres sensitives n'ont pas de dispositions spécifiques ni de dispositions hiérarchiques selon leur diamètre, elles sont donc dispersées autant au centre qu'en périphérie. Il en sera autrement une fois entrées dans les trous de conjugaison.
40 - Le système de transport des influx nociceptifs: l'architecture hiérarchique des racines portérieure
Lors du transit par les racines postérieurs, les fibres nociceptives de même que les autres fibres sensitives jusqu'alors étalées et entre-mêlées dans les faisceaux nerveux périphériques avec les fibres motrices sans aucune disposition particulière, commencent à se disposer hiérarchiquement selon leur diamètre. Cette redispostion hiérarchique débute au niveau du trou de conjugaison i.e. à partir du moment où les racines sont recouvertes par la première couche méningée, la pie-mère, et cette disposition se maintient dans la zone d'entrée de la moelle et ce jusque dans la corne postérieure.
- Les plus grosses fibres, les fibres A alpha et A bêta dédiées au transport de la proprioception consciente i.e. la discrimination tactile (discrimination deux points), le sens de la position, le sens de vibration qui se fait dans les cordons postérieurs (faisceaux cuneatus et gracilis) se disposent dans la portion la plus postérieure ou dorsale de la racine. Elles peuvent ainsi se rendre, au niveau de la corne postérieure, vers la portion la plus médiane de celle-ci.
-
Les fibres de très petit diamètre, les fibres nociceptives C, se disposent dans la portion antérieure de la racine. Elles peuvent ainsi entrer immédiatement dans la portion la plus latérale de la moelle.
-
Les fibres de faible diamètre, A delta, en prédominance nociceptives, se disposent dans la portion moyenne de la racine, entre les fibres A alpha - A bêta et C. Elles peuvent ainsi se rendre, au niveau de la corne postérieure, vers la portion la plus intermédiaire de la corne postérieure, entre la zone de distribution des fibres A alpha - A bêta et C.
Même si elles n'ont pas de contribution à la nociception, les fibres A alpha et A bêta (proprioception consciente i.e. la discrimination tactile (discrimination deux points), le sens de la position, le sens de vibration), après leur entrée dans la moelle se divisent pour émettre deux axones:
-
un premier axone qui compose les cordons postérieurs et qui acheminent alors l'information discriminative et proprioceptive vers les centres supérieurs (c'est leur fonction première)
et
- un deuxième axone qui est en fait une collatérale dédié vers la corne postérieure. Cette collatérale vers la corne postérieure apporte ainsi la contribution "modulatrice" des grosses fibres A alpha et A bêta dont il sera discutée plus loin (Voir: L'EFFET "PORTILLON" (GATE CONTROL) SELON MELZACK ET WALL ET UNE PLUS NOUVELLE THEORIE: LE CONTROLE INHIBITEUR DIFFUS INDUIT PAR LA NOCICEPTION (CIDN)).
41 - Les fibres sensitives nociceptives et autres: le positionnement du corps cellulaire
Le corps cellulaire de toutes les fibres sensitives de C1 à S5 se retrouve dans le ganglion dorsal de la racine postérieure. Le ganglion dorsal est le gonflement anatomique présent au niveau de la racine postérieure à la hauteur du trou de conjugaison. Dans la perspective afférente de la nociception, la racine périphérique se divise en racine antérieure et en racine postérieure immédiatement avant son entrée par le trou de conjugaison et le ganglion dorsal survient immédiatement après cette division.
Le corps cellulaire de toutes les fibres nociceptives "crâniennes" et même plus de toutes les fibres sensitives "crâniennes" en provenance de
- la face (peau, structures osseuses, articulations temporo-mandibulaires),
- la cornée
- les sinus
- les muqueuses nasales, sinusales et buccales,
- la partie antérieure de la langue,
- la dentition,
se retrouve dans le ganglion du trijumeau aussi appelé ganglion semi-lunaire ou de Gasser (Gasserian), situé dans l'espace intra-crânien à la base du crâne sous le lobe temporal dans une citerne dure-mérienne elle-même prenant place dans une empreinte de l'os temporal: le cavum de MECKEL. Dans la portion extra-crânienne du trijumeau, les afférences fortement étalées finissent par former trois branches (ophtalmique (I), maxillaire (II) et mandibulaire (III)) qui pénètrent dans l'espace intracrânien à travers la stucture osseuse faciale antérieure par trois foramen différents. Ces foramen sont en fait les équivalents des trous de conjugaison pour les espaces intervertébraux:
-
la branche ophtalmique (V-1) uniquement sensorielle pénètre dans l'espace intra-crânien par la fissure orbitaire supérieure et qui se réunissent dans la paroi latérale du sinus caverneux,
-
la branche maxillaire (V-2) elle aussi uniquement sensorielle pénètre dans l'espace intra-crânien par le foramen rotondum à la base du crâne,
- la branche mandibulaire (V-3) sensorielle et motrice (masticateurs, tensor tympani et quelques autres) pénètre dans l'espace intra-crânien par le foramen ovale.
42 - Le système de transport des influx nociceptifs périphériques: le terminus périphérique médullaire des influx C1 à S5
Les fibres nociceptives en provenance de la racine postérieure pénètrent dans la moelle au niveau de la région postérieure et la zone où se fait cette entrée s'appelle la corne postérieure. La portion de la corne postérieure où se terminent les fibres nociceptives s'appelle la substance grise.
43 - Le système de transport des influx nociceptifs périphériques: le terminus périphérique tronculaire des influx craniens
Au niveau du tronc cérébral, la substance grise de la corne postérieure possède son équivalent dans le noyau spinal du trijumeau Ce noyau reçoit les afférences nociceptives des différentes structures crâniennes. Après avoir fait leur entrée dans le tronc cérébral par le nerf V au niveau de la protubérance, les fibres nociceptives périphériques forment un long faisceau descendant dans le tronc cérébral, c'est le faisceau spinal du trijumeau. Immédiatement accolé à ce faisceau descendant, se trouve, un peu plus en médial, le noyau spinal du trijumeau où les afférences nociceptives du V se termineront.
Les afférences autres que nociceptives en provenance des structures crâniennes arrivent au niveau du noyau sensoriel principal du trijumeau. Les événements relativement complexes survenant au niveau de la corne postérieure s'appliquent tout autant au noyau spinal du trijumeau.
44 - Le système de transport des influx nociceptifs périphériques: le terminus périphérique et ses variantes
Autant au niveau de la corne postérieure qu'au niveau du noyau spinal du trijumeau, les fibres nociceptives se terminent dès qu'elles ont fait leur entrée dans la substance grise de la corne postérieure, elles se terminent donc du même côté où elles ont pénétré, c'est donc dire que la terminaison des fibres nociceptives est ipsilatérale.
Cependant, un certain nombre de fibres nociceptives vont se rendre directement dans la substance grise de la corne postérieure controlatérale en passant derrière le canal central médullaire.
Par ailleurs, comme rapporté un peu plus antérieurement, alors que la majorité des fibres nociceptives pénètrent dans la moelle par la racine postérieure pour aller terminer immédiatement à leur entrée i.e. en ipsilatéral, un certain nombre de fibres nociceptives C font exception et font leur entrée par les racines antérieures pour se diriger elles aussi dans la corne postérieure ipsilatérale.
Il convient ici d'insister sur deux particularités en ce qui concerne la terminaison des fibres nociceptives au niveau de la corne postérieure:
-
un certain nombre de fibres nociceptives font leur entrée par les racines antérieures, parmi celles-ci :
-
un certain nombre de fibres nociceptives vont se rendre dans la corne postérieure du même côté (ipsilatéral)
-
un certain nombre de fibres nociceptives vont se rendre dans la corne postérieure du même côté (ipsilatéral)
- un autre groupe de fibres nociceptives qui ont fait leur entrée par la racine postérieure vont se rendre directement dans la substance grise de la corne postérieure controlatérale.
-
-
Ces particularités permettent d'expliquer "en partie" pourquoi la section d'une racine postérieure (rhizotomie) peut apporter un soulagement partiel des douleurs sans permettre d'éliminer complètement les douleurs. Elles lèvent aussi le voile sur les incongruences dans les résultats lors de certaines autres interventions neurochirurgicales à visée analgésique dont il sera fait mention dans le Manuel V de cette série portant sur les approches non-médicamenteuses.
45 - Le système de transport des influx nociceptifs périphériques: l'éparpillement multi-étage
Après avoir ainsi fait leur entrée dans la moelle, les fibres C et A delta se divise en plusieurs branches qui prennent alors trois directions:
-
certaines demeurent au même étage que leur niveau d'entrée, ce sont les branches segmentaires
-
d'autres se dirigent vers les étages supérieurs ce sont les branches montantes et on parle alors de direction "cephalad"
et
-
d'autres se dirigent vers les étages inférieurs, ce sont les branches descendantes et on parle alors de direction "caudad".
Les fibres qui prennent ainsi les directions "cephalad" et "caudad" voyagent dans un réseau "ascenseur" situé à l'entrée immédiate de la moelle, le faisceau de Lissauer.
Ainsi, tout s'organise pour que l'information nociceptive puisse rapidement aviser plusieurs étages médullaires d'un problème en périphérie.
46 - L'éparpillement multi-étage: la différence entre les afférences somatiques et viscérales
La majorité des afférences nociceptives somatiques
- limitent habituellement leurs incursions à 1 ou 2 étages plus haut et plus bas que leur point d'entrée pour faire un éparpillement total sur 3 à 4 étages
alors que les afférences nociceptives viscérales
- ont tendance à s'éparpiller sur 2 à 3 étages autant en cephalad qu'en caudad, pour faire un éparpillement total sur 5 à 6 étages au total.
Les conséquences de cet éparpillement se concrétiseront quand viendra le temps d'expliciter les douleurs "référées", particulièrement les douleurs référées viscérales.
Cet éparpillement se manifeste sous divers aspects comme il sera discuté ultérieurement. Il aide à mieux comprendre:
- la douleur "référée"
- la limite des bénéfices analgésiques par les interventions reposant sur les blocs radiculaires et les sections radiculaires.
47 - Le terminus périphérique et le premier relais central: la corne postérieure et sa constitution en couches
La corne postérieure où se terminent les fibres nociceptives C et A delta périphériques, se divise en de nombreuses couches (laminae), plus d'une dizaine. Ces couches sont formées principalement:
-
des corps cellulaires des faisceaux nociceptifs "centraux" ascendants ou afférents
mais aussi -
de cellules intermédiaires remplissant différentes fonctions
et - de courts neurones (interneurones) remplissant eux aussi différentes fonctions dont celles de modulation.
Cet arrangement en couche est fait de façon très ordonnée. Chacune des dix couches contient une représentation "cartographique" de la surface du corps. Cette configuration "cartographique" au niveau de la corne postérieure est l'équivalent de l'homonculus cortical que l'on retrouve au niveau des cortex moteurs et sensitifs. On y réfère sous le nom de "cartographie somatotopique".
Les couches (laminae) I, II, III, IV, V, VI, et VII sont impliquées dans le transfert des influx nociceptifs mais mais les couches I à V sont les couches les plus particulièrement concernées. On réfère souvent aux quatre couches I-II-III-IV dans une nomenclature qui se divise en trois portions:
- la zone marginale (de Waldeyer) qui est l'équivalent de la couche I
-
la substance gélatineuse (substancia gelatinosa) qui est l'équivalent de la couche II
et - le nucleus proprius qui comprend les couches III et IV.
La couche V est aussi très concernée par les transferts nociceptifs, elle est le siège des neurones convergents (Wide-Dynamic-Range) qui recoivent tous les types d'afférences et de toutes les structures (peau, muscles/os/articulations, viscères).
Les fibres A delta, qu'elles soient demeurées au même étage ou qu'elles aient cheminé dans le faisceau de Lissauer (voir: LE SYSTEME DE TRANSPORT DES INFLUX NOCICEPTIFS PERIPHERIQUES: L'EPARPILLEMENT MULTI-ETAGE), se terminent
- principalement dans la couche I (ZONE MARGINALE)
-
secondairement dans la couche V
et - aussi quelque peu dans la couche II latérale.
Les fibres C, qu'elles soient demeurées au même étage ou qu'elles aient cheminé dans le faisceau de Lissauer (voir: LE SYSTEME DE TRANSPORT DES INFLUX NOCICEPTIFS PERIPHERIQUES: L'EPARPILLEMENT MULTI-ETAGE), se terminent
-
de façon nettement préférentielle dans la couche II (SUBSTANCE GÉLATINEUSE)
et - aussi quelque peu dans les couches I et V.
Les afférences sensitives (non-nociceptives) des grosses fibres A alpha et A bêta se divisent en deux contingents, un premier qui monte dans les cordons postérieurs, un second qui se termine
-
de façon nettement préférentielle dans les couches III, IV et V
et -
aussi quelque peu dans les couches II et VI.
C'est donc dire que la couche V reçoit des afférences de tous les types de fibres sensitives: A alpha, A bêta, A delta et C. On verra plus loin que la couche V reçoit des afférences de toutes les structures anatomiques, soient des afférences cutanées, musculo-squelettiques et viscérales. Voilà peut-être encore une portion des explications pour les douleurs référées!
Trois groupes de structures anatomiques fournissent des afférences à la corne postérieure, ce sont les groupes d'origine
- cutanée,
-
musculo-squelettique
et - viscérale.
Parmi ces trois groupes, chaque groupe d'afférences possède ses couches préférentielles. Ainsi, les afférences d'origine viscérale, musculo-squelettique et d'origine cutanée se comportent chacune différemment. Les afférences d'origine viscérale et musculo-squelettique n'envoient pas de projections dans les couches II, III et IV; c'est donc dire qu'elles sont absentes de la substance gélatineuse et du nucleus proprius.
Les afférences d'origine musculo-squelettique
- envoient leurs projections dans les couches I (marginale) et dans les couches V et VI
alors que
-
les afférences d'origine viscérale
- envoient leurs projections dans les couches I, V, VII et X. Bien plus, les afférences d'origine viscérale envoient souvent leurs projections de façon bilatérale.
-
et
les afférences d'origine cutanée
-
abondent dans les couches I et II et se retrouvent quelque peu dans la couche V.
En regard de la surface cutanée, chaque neurone nociceptif est connecté à une portion anatomique spécifique de la surface cutanée, cette portion s'appelle "le champ récepteur". Chaque champ récepteur constitue une toute petite portion d'un dermatome, un dermatome étant la surface cutanée dont l'innervation est associée de façon préférentielle à une racine particulière (ou nerf spinal). Chaque champ récepteur recouvre une partie d'un autre champ récepteur lui aussi nociceptif. Il existe ainsi une importante superposition de champs récepteurs pour toute surface donnée. Par ailleurs, à l'exemple des champs récepteurs nociceptifs, chaque type de perception sensorielle posséde ses propres champs récepteurs ce qui amène finalement un important chevauchement de différents champs récepteurs appartenant chacun à des afférences sensorielles différentes.
48 - Le terminus périphérique et le premier relais central: la corne postérieure, le bouton pré-synaptique et les espaces synaptiques
Les fibres nociceptives se terminent dans différentes couches de la corne postérieure comme mentionné précédemment. A leur point de terminaison, les fibres connaissent un léger renflement auquel on réfère comme étant le bouton pré-synaptique.
Par le bouton pré-synaptique, les fibres se connectent avec une fibre dite "centrale". La zone où se fait l'interconnexion "bout à bout" entre deux fibres nerveuses s'appelle une synapse. Une synapse est un espace réel entre les deux extrémités des fibres nerveuses qui s'interconnectent. Cet espace anatomique réel est borné par deux membranes neuronales, la membrane pré-synaptique, celle qui transmet l'influx et la membrane post-synaptique, celle qui reçoit l'influx.
C'est donc dire que la corne postérieure s'avère un lieu où se déroule un nombre incalculable d'interconnexions, non seulement elles s'y déroulent mais elles y sont aussi gérées. La corne postérieure, siège de millions d'interconnexions synaptiques, est un peu à l'image de la cour de triage la plus complexe qu'il pourrait être possible d'imaginer. Les millions d'axones "périphériques nociceptifs" contenus dans les racines échangent à ce niveau leur information avec les fibres centrales.
On verra dans le cas des douleurs qui se prolongent le moindrement que la gestion de ce réseau complexe d'échanges peut devenir difficile et même connaître une désorganisation déroutante ouvrant ainsi la voie à des douleurs intenses, étendues et difficile à maîtriser.
49 - La transmission d'un influx dans l'espace synaptique: le bouton pré-synaptique et la libération d'un neurotransmetteur
Lorsqu'un influx nociceptif ou autre arrive au niveau du bouton pré-synaptique, une cascade d'événements électrochimiques se produit:
-
l'arrivée de cet influx entraine un début de dépolarisation qui s'accentue jusqu'à déclencher l'ouverture de canaux sodiques (Na+) et calciques (Ca++) "VOLTAGE DÉPENDANTS" situés sur la membrane du bouton pré-synaptique,
-
l'ouverture de ces canaux amène le potentiel transmembranaire au niveau du seuil d'activation, d'autres canaux "voltage dépendants" s'ouvrent alors pour provoquer l'arrivée plus massive de (Ca++) à l'intérieur du bouton pré-synaptique. Cette arrivée plus massive est responsable du "soutien métabolique excitateur" intra-cellulaire. L'usine métabolique intracellulaire se met en branle,
-
de fait, ce soutien engendre la production et la libération de NTs nociceptifs ou "excitateurs" dans l'espace synaptique,
- les NT nociceptifs qui se retrouvent alors dans l'espace synaptique vont se fixer sur leurs récepteurs spécifiques au niveau de la membrane post-synaptique afin de recréer l'influx dans la fibre nociceptive centrale cette fois-ci.
La libération de NTs se fait en quantité "déterminée" à laquelle on donne le nom de "quantum". Ainsi, l'arrivée d'un train d'influx au niveau du bouton pré-synaptique libère un certain nombre de quanta, ces quanta entraînent dans le cas de NTs "excitateur" un certain degré de dépolarisation de la membrane post-synaptique. Plus le nombre de quanta augmente, plus il devient possible d'atteindre le seuil d'activation nécessaire pour déclencher les potentiels d'action générant, de ce fait, un nouveau train d'influx "nociceptifs" cette fois-ci dans la fibre centrale qui vient d'être activée. Et il en est ainsi, tout au long de l'ascension vers les régions supérieures où se feront les relais "nociceptifs".
C'est la quantité de (Ca++) migrant à l'intérieur du bouton pré-synaptique qui fait la régulation du nombre de quanta libérés. L'usage d'inhibiteurs calciques agissant spécifiquement sur le réseau nociceptif pourrait donc trouver une application co-analgésique à ce niveau, les bloqueurs calciques usuels n'ont pas d'effet à ce niveau et ne font donc pas partie de l'arsenal courant de co-analgésiques cependant le gabapentin et les médicaments de sa famille pourraient peut-être posséder une partie de cet effet.
On verra plus loin que l'effet des NTs pourra être autant "excitateur" i.e. activer l'activité métabolique à l'intérieur de la cellule que "inhibiteur" i.e. réduire cette même activité.
50 - La transmission d'un influx dans l'espace synaptique: la membrane synaptique et ses deux grandes familles de récepteurs
Les récepteurs "biochimiques" présents sur les membranes pré et post-synaptiques sont des récepteurs moléculaires complexes qui peuvent se retrouver en deux endroits:
-
directement à la surface des canaux ioniques
ou - directement à la surface de la membrane neuronale.
Lorsque les récepteurs moléculaires sont situés à la surface de canaux ioniques, leur activation entraîne un
- effet rapide immédiat qui peut être de deux ordres, une rapide dépolarisation ou une rapide hyperpolarisation.
Lorsque les récepteurs moléculaires sont situés à la surface de la membrane neuronale, leur activation nécessite
-
plus de temps avant d'entraîner leurs effets. Ils doivent en effet passer par un intermédiaire chimique, un second messager, habituellement un sous-type de protéine du groupe des protéines G. Le sous-type de protéine G concerné doit alors se rendre activer d'autres récepteurs cibles qui lui sont propres à l'intérieur de la cellule. On assiste alors à une cascade d'activation enzymatique intra-cellulaire, chaque nouvelle structure activée enclenchant d'autres processus métaboliques dont l'aboutissement final sera de produire enfin le ou les effets désiré(s).
Dans le cas du contrôle des canaux ioniques, la résultante finale sera d'ouvrir ou de fermer les canaux ioniques cibles mais cette fois-ci à partir d'un stimulus venant de l'intérieur. Encore ici, l'effet final pourrait être une dépolarisation ou une hyperpolarisation mais cet effet sera retardé en comparaison avec la stimulation directe des canaux ioniques à la surface extra-cellulaire.
L'augmentation ou la réduction de l'excitabilité membranaire est donc liée à une chaîne de processus métaboliques intra-cellulaires qui imposent un certain délai avant de se répercuter sur les canaux ioniques visés. Les canaux ioniques activés par les récepteurs membranaires sont donc impliqués plus tardivement en comparaison de ceux possédant des récepteurs immédiatement à leur surface.