Notes personnelles dans une perspective de soins palliatifs "oncologiques" Par : Brizard, André, MD
| Chapitres 2 à 50 | ||
| Chapitres 51 à 100 | ||
| Chapitres 101 à 150 | ||
| Chapitres 151 à 203 | ||
| Tous les chapitres de 1 à 203 |
1- Introduction
Oserions-nous aujourd'hui traiter le cancer d'une personne sans avoir, au préalable, examiné les caractéristiques histopathologiques de ce cancer au microscope ?
En l'absence d'une identification adéquate des caractéristiques histopathologiques du cancer à traiter, il serait impossible de faire un choix adéquat parmi l'arsenal de chimiothérapie et toute administration d'un protocole quelconque deviendrait tout à fait aléatoire et les résultats thérapeutiques qui s'ensuivraient le seraient tout autant. Bien sûr, ce choix pourrait parfois, par un hasard des plus heureux, être bénéfique pour la personne mais, alors, tout n'aurait été qu'une question de chance.

Or, le traitement de la douleur ressemble parfois au "traitement analgésique" que l'on aurait voulu ainsi appliquer "à tout hasard" contre un cancer. La douleur reçoit alors un traitement sans que les caractéristiques de cette douleur ne soient adéquatement connues au préalable.
En effet, si on ne s'attarde pas à faire une évaluation de la ou des douleurs selon une perspective pathophysiologique et si on applique un traitement analgésique sans diagnostic pathophysiologique, la situation devient analogue à la situation précédente. Le choix des médicaments, parmi l'arsenal des analgésiques et des co-analgésiques, risque alors de se faire de façon aléatoire avec un résultat qui risque d'être fort incertain sur le plan du soulagement, comme il fallait s'y attendre. Bien sûr, ce choix pourrait parfois, comme dans les circonstances précédentes, par un hasard des plus heureux, être bénéfique pour la personne qui a mal mais, alors, tout n'aurait été encore qu'une question de chance. Il faudrait souhaiter que le traitement "aléatoire ou intuitif" des douleurs disparaisse le plus possible parce qu'il est possible, la plupart du temps, de procéder avec rationalité dans ce domaine comme dans beaucoup d'autres de la médecine.
Le traitement "à tout hasard" des douleurs risque de souvent se résumer à considérer, sous le motif du contexte de soins palliatifs, qu'il n'existe aucun autre choix possible que celui des opiacés. Une telle considération équivaut à faire l'équation terriblement erronée suivante, à savoir douleur = opiacés. Les marges de manoeuvre qui s'ensuivent deviennent donc extrêmement réduites puiqu'alors la seule démarche qui s'offre, face à une douleur qui ne cède pas, s'avère d'augmenter la dose de "narcotique ". Des situations fort désagréables risquent alors de survenir. Une telle situation serait alors analogue à l'utilisation d'un seul type de chimiothérapie appliquée sans considération pour les caractéristiques histopathologiques du cancer et où la seule option restante, face à un cancer qui ne répond pas, aurait été d'augmenter la dose de chimiothérapie sans égard aux effets secondaires de la substance utilisée.
Et les conclusions qui pourraient faire suite à l'équation "douleur = opiacés" pourraient être tout aussi erronées puisqu'on ira parfois jusqu'à affirmer que "le patient ou la patiente" n'a pas répondu aux "narcotiques", comme si la personne y était pour quelque chose dans les mécanismes de sa douleur et dans la réponse de ces mécanismes au traitement "aléatoirement retenu". Ce n'est pourtant pas la personne qui est en cause, ce n'est pas la personne qui "a décidé" de ne pas répondre au traitement, c'est plutôt que la pathophysiologie de telle douleur se prête plus ou moins bien à l'usage des opiacés tout comme plusieurs types de cancer qui sont résistants à telle ou telle type de chimiothérapie.
En corollaire à de telles considérations, on en viendra même, parfois, à considérer que tout ce qu'il restait à faire pour faire céder cette douleur "rebelle"aura été d'augmenter la dose d'opiacé au point de couper la personne de sa réalité de vie.
Regrettable, immensément regrettable comme approche. Les opiacés peuvent offrir d'extraordinaires bienfaits lorsqu'ils sont utilisés correctement; à l'opposé, lorsqu'ils sont utilisés incorrectement, il peuvent causer d'énormes méfaits.
Les choix parmi les modalités à visée analgésique, autant pharmacologiques que non pharmacologiques, et les bénéfices analgésiques`"estimés" découlant de ces différents choix devraient reposer sur :
- une connaissance adéquate des différentes pathophysiologies de la douleur,
- une évaluation "physiopathologiques" des douleurs d'une personne qui a mal,
- un choix approprié, pertinent et équilibré parmi les interventions à visée analgésique possibles, et finalement,
- sur le strict respect des principes de base dans l'utilisations des co-analgésiques ou des opiacés lorsque ceux-ci sont utilisés
C'est sur ces prémisses que la série "Ces personnes qui ont mal" a été écrite.
2 - Contenu
Le matériel éducatif qui suit: "Ces personnes qui ont mal" - "Notes personnelles dans une perspective de soins palliatifs "oncologiques"" propose un contenu de connaissances sur le domaine de la douleur. Il se divise en six (6) manuels dédiés à des thèmes complémentaires.

1. Les différents types de douleur selon les bases pathophysiologiques et psychoaffectives.
( Douleur physique et douleur "totale" ou "globale" )3 - Avant-propos
Ce projet de matériel éducatif découle tout particulièrement de l'intégration d'expériences cliniques répétées vécues au fil des années depuis 1985 en soins palliatifs auprès de personnes en phase palliative et terminale de cancer et qui éprouvaient des douleurs et de la souffrance.
Il ne prétend pas appartenir aux savants traités sur la douleur. Il découle d'une structuration d'observations, de lectures, de déductions et de notes personnelles accumulées au cours des années. Il ne se veut pas exhaustif non plus. Ce projet se veut uniquement un effort personnel pour faire oeuvre de vulgarisation face à des notions qui nous paraissent le plus souvent d'une extrême complexité. Il s'adresse particulièrement aux intervenants de première ligne du monde de la médecine, des soins infirmiers et de la pharmacie.
Aucun effort n'a été épargné pour offrir des connaissances conformes à la littérature dans le domaine de la santé. Le contenu de ces différents documents sera toujours perfectible surtout en tenant compte de l'avancement des connaissances dans les domaines à la fois fondamentaux et cliniques de la douleur. Le défi de vouloir faire oeuvre de vulgarisation nécessite de toujours tenter de conserver un certain équilibre entre le fondamental et l'utile et c'est ce qui a été tenté tout au long de ces écrits.
4 - Droits d'auteur
Ce matériel éducatif peut être copié et reproduit, en partie ou en totalité, mais ne peut, à aucun moment, être modifié sans la permission écrite de l'auteur qui peut être obtenue à l'adresse suivante:
André Brizard, m.d.
Centre Hospitalier Universitaire de Sherbrooke - Fleurimont (CHUS-F)
3001, 12e avenue Nord
Sherbrooke J1H 5N4
Québec, Canada5 - Remerciements
Qu'il me soit permis à travers ce premier manuel d'exprimer des remerciements à tous ceux et celles qui ont rendu sa réalisation possible.
Les premiers remerciements s'adressent au Dr. Alexandre Madernas (B.Sc., M.Sc., MD) pour la révision en profondeur du manuel dans sa version 1998.
Je voudrais aussi remercier les différents collaborateurs qui ont accepté de revoir le contenu de ce manuel de même que ses différents aspects et qui ont proposé une précieuse gamme de commentaires et de suggestions très appréciés. Ma reconnaissance s'adresse aussi à Michèle Brizard, mon épouse et consoeur de travail, qui m'a soutenu tout au long de ce projet.
6 - Mise à jour
Des modalités de "MISE A JOUR" seront disponibles dans la mesure où vous cochez la case "Me contacter par courriel pour des nouveautés sur le site".
7 - Commentaires - Questions - Suggestions
Tout élément suivant:
QUESTIONS
COMMENTAIRES
SUGGESTIONS
CORRECTIONSrelatifs à l'utilisation de ce matériel éducatif et pouvant mener à
* une meilleure utilisation et à une meilleure compréhension de son contenu
* un ou des ajouts non élaborés dans le présent document
peuvent être adressés à:André Brizard M.D.
Centre Hospitalier Universitaire de Sherbrooke - Fleurimont
3001, 12e avenue Nord
Sherbrooke, J1H 5N4
Québec, Canadaou à l'adresse E-mail suivante: andre.brizard@USherbrooke.ca
8 - Page titre
MANUEL 1
Les différents types de douleur
Les composantes physiques et les bases pathophysiologiques
Les composantes non-physiques c.-a.-d. affectives ou émotionnelles et les bases psycho-socio-spirituelles
9 - Généralités
Ce premier manuel a pour but de fournir certaines connaissances de base permettant d'intervenir dans le domaine de la douleur avec un bon potentiel de bénéfices analgésiques.
Avant d'élaborer sur le soulagement de la douleur avec les opiacés, les co-analgésiques et les approches non pharmacologiques, il est essentiel de bien comprendre le type ou les types de douleurs auxquels on s'adresse, tout comme il importe de bien comprendre les effets des composantes non organiques, i.e. affectives et émotionnelles sur la modulation et la perception globale de la douleur.
Ce n'est qu'après avoir bien compris les bases pathophysiologiques des divers types de douleur qu'il sera possible, dans un deuxième temps, de bien évaluer la douleur.
En conséquence, l'évaluation de la douleur, ou plutôt des divers types de douleur, se devra de reposer, d'abord et avant tout, sur une bonne connaissance de la pathophysiologie des douleurs. Cette évaluation, faite au chevet du patient, se devra de miser sur le meilleur de tous les outils d'évaluation: un questionnaire "bien dirigé" qui soit adressé avec discernement à la personne qui a mal.
Les modalités d'investigation que sont les radiographies, la tomodensitométrie ou tomographie axiale (TACO), la résonance magnétique (RMI) et la médecine nucléaire (Scintigraphie osseuse et TEP), fournissent des renseignements extraordinaires sur l'étendue du fardeau tumoral sans jamais livrer, sur la douleur, les informations capitales que le plus simple questionnaire permet d'obtenir. Ces moyens technologiques très perfectionnés ne fournissent et ne fourniront probablement jamais l'information sur la localisation de la douleur, son intensité et son caractère. Le questionnaire "bien dirigé", lui, permet d'obtenir toutes ces informations.
Ce n'est qu'après avoir procédé à une évaluation des divers types de douleur, en basant cette évaluation sur une bonne connaissance de la pathophysiologie, qu'il sera logique de parler ensuite d'approches adéquates de soulagement des douleurs.
C'est le but de cette série de proposer une base rationnelle à toutes les démarches à visée analgésique.
10 - La première et la plus essentielle des étapes
Voilà donc quelques raisons-clé permettant d'introduire la première et la plus essentielle de toutes les étapes dans le traitement de la douleur:
" le retour à la pathophysiologie de base sans laquelle notre démarche thérapeutique ultérieure risque de n'avoir aucune logique même si elle peut parfois permettre de soulager ou d'atténuer la douleur, comme il a été mentionné dans l'introduction."
En effet, il est possible de soulager ou d'atténuer les douleurs, sans savoir exactement à quel type de douleur on s'adresse, sans même parfois savoir ce qu'on vise exactement avec tel ou tel choix thérapeutique. Le traitement de la douleur se devrait de dépasser les simples recettes, il devrait plutôt toujours tenter de reposer sur une base rationnelle.
La douleur est subjective, toujours subjective. Personne ni même aucune méthode ne peut se substituer à celui ou celle qui a mal pour dire sa douleur. Il est cependant de notre devoir d'essayer de la comprendre dans toute sa dimension avant d'en exercer la gestion. Voilà le but visé par les différents manuels de cette série "Ces personnes qui ont mal".11 - Le principe des principes
La douleur est toujours subjective. Il n'existe aucune méthode ni aucun instrument qui permette d'en quantifier l'intensité de façon objective. Il existe bien sûr des moyens indirects comme la mesure des variations de la respiration ou des battements cardiaques applicables uniquement dans les premiers jours des douleurs aigues, mais ces méthodes ne livrent que des valeurs approximatives.
Dans une monographie publiée en 1984 par Santé et Bien-Etre social Canada, on peut lire l'énoncé suivant qui constitue le premier de tous les principes, le principe des principes, en ce qui concerne la gestion de la douleur:
"La douleur est toujours subjective; elle est ce que le malade affirme et non ce que les autres croient qu'elle devrait être."
Dans les mots de tous les jours, cet énoncé peut se comprendre ainsi:
La douleur est telle que les gens la décrivent et non pas telle que "MOI" je pense qu'elle est.
Cet énoncé constitue le principe fondamental de toute intervention dans le domaine de la douleur. Dans ce champ d'intervention, il n'y a pas de place pour celui/celle qui refuse d'adhérer entièrement à ce principe. Si jamais un/une intervenant(e) quelconque du domaine de la santé se refusait d'adhérer entièrement à ce principe, il serait nettement préférable qu'il/elle laisse sa place à quelqu'un d'autre et cela autant pour ce qui est de l'évaluation des douleurs que pour la gestion de ces mêmes douleurs.
En face d'une personne atteinte de cancer, de SIDA ou en phase palliative d'une autre maladie organique débilitante, il n'y a malheureusement pas de place pour le doute dans le processus d'évaluation des douleurs car aucune personne ou méthode ne peut se substituer à celui ou a celle qui souffre pour décrire sa douleur. Il y a bien assez que la douleur soit "subjective", il n'y a pas de place pour que l'évaluateur (trice) n'ajoute son propre doute comme second niveau de subjectivité dans l'évaluation des douleurs et dans l'élaboration du diagnostic. Il n'est pas souhaitable que la douleur soit alors soumise à la subjectivité d'un "tous et chacun" procédant à l'évaluation. L'adhérence au principe des principes est tout à fait primordiale.
Il y a une autre conséquence au doute car lorsque celui-ci survient, risque d'apparaître en même temps un peu le mépris. On peut alors imaginer combien il devient malheureux pour une "personne qui a mal" de devoir subir, en plus des impacts de sa maladie et de ses douleurs, "le mépris" de certains des intervenants de la santé dont elle est pourtant tributaire pour ses médicaments.
Cette double subjectivité, risque finalement de pénaliser considérablement la personne qui a mal puisque celui/celle qui procède à l'évaluation est souvent celui/celle qui prescrit l'analgésie. Le médecin, qui par la force des choses est toujours "juge et partie" dans tout le processus d'évaluation et de gestion des douleurs, n'est particulièrement pas à l'abri de cette double subjectivité et de ses effets. En devenant mauvais juge, il risque de corrompre "les autres parties", c'est-à-dire les autres soignants et cela, au plus grand détriment de "la personne qui a mal". Rôle délicat, donc, que celui de travailler dans le domaine de la douleur. Rôle qui commande beaucoup d'attention et de délicatesse et même ... beaucoup ... "d'amour" comme nous le verrons dans le chapitre V portant sur les approches non-pharmacologiques.
La personne qui a mal ne devrait jamais se retrouver à la merci des humeurs et des états d'âme des soignants dont elle dépend.
12 - Le principe des principes et l'atteinte cognitive
Cependant, ce principe cardinal risque d'être plus difficilement respecté et applicable dans le cas des personnes ayant une atteinte cognitive car il risque de perdre tout son sens. En effet, le principe selon lequel "La douleur est telle que les gens la décrivent ..." perd alors toute sa signification car le patient ne peut décrire sa douleur, ou encore, la description qu'il en fait risque d'être dénudée de toute valeur informative; le piège de l'interprétation subjective s'ouvre alors tout grand. Malheureusement, aucun moyen technique ni aucune investigation perfectionnée ne permettent d'obtenir l'information qu'une saine communication apporte lorsqu'un questionnaire judicieusement orienté est adressé à la personne qui souffre.
Dans le cas des personnes ayant une atteinte cognitive, il faut donc revenir à des critères d'évaluation à tout le moins reproductibles afin que cette évaluation se fasse le plus objectivement possible. En présence d'une atteinte cognitive, le défi devient donc énorme. Aucun de nous ne doute que ces personnes puissent éprouver de la douleur. Elles sont cependant incapables de nous dire leurs douleurs avec des mots. Nous aborderons ce thème en détail dans le Manuel II portant sur l'évaluation des douleurs.
13 - La gestion appropriée de la douleur: six éléments-clé
La gestion appropriée de la douleur est l'objectif final de toutes nos interventions.
Cependant, pour atteindre une gestion appropriée de la douleur, il est essentiel que chacune des interventions repose sur six éléments-clé.
Premièrement,
la gestion appropriée de la douleur sous-entend une connaissance adéquate des divers types de douleur sur laquelle cette maîtrise repose. Quand on travaille dans le domaine de la gestion analgésique, on réalise rapidement, dans un certain sens, que "la" douleur n'existe pas! Le terme "douleur", comme on y fait référence généralement, représente plutôt un ou plusieurs types de douleurs, caractérisés par un ou par divers mécanismes pathophysiologiques bien distincts.
La douleur n'existe pas plus que la couleur. La couleur se définit par ses composantes, c'est-à-dire le bleu, le jaune, le rouge, etc. Il en va de même pour la douleur.
Cette affirmation doit bien sûr être considérée dans un contexte clinique où le défi consiste à distinguer les divers types de douleur en cause afin de choisir la ou les meilleures approches analgésiques.
Il faut donc apprendre à traiter chacune des pathophysiologies de la douleur et non pas la douleur dénuée de tout substrat pathophysiologique. Il faut simultanément tenir compte de l'intégration des nombreuses composantes physiques et non-physiques et non seulement de la pathophysiologie organique en cause.
Deuxièmement,
pour tenter d'offrir une gestion appropriée de la douleur, il faudrait que l'évaluation de la ou des douleur(s) soit guidée par cette connaissance de ce que sont les divers types de douleur.
Troisièmement,
une fois le diagnostic d'un ou de divers types de douleur établi, la gestion appropriée de la douleur devrait reposer sur une bonne connaissance des analgésiques, qui sont en fait les opiacés, et des co-analgésiques qui regroupent l'ensemble de tous les autres médicaments dotés, pourrait-on dire, d'un effet secondaire "désirable", c'est-à-dire un effet analgésique.
Quatrièmement,
la gestion appropriée de la douleur exige que la personne traitée, sa famille et/ou ses proches soient bien informés sur le ou les médicaments utilisés, les posologies et les effets secondaires. L'ensemble des interventions à visée analgésique doit aussi reposer sur une collaboration optimale entre la personne atteinte et celui/celle qui prescrit. Cette condition pose un problème majeur en présence d'une atteinte cognitive.
Cinquièmement,
si on utilise des opiacés, il est extrêmement important que l'on identifie les mythes, les peurs, les craintes et les résistances qui entourent l'emploi de ces médicaments. Il peut être tellement désolant qu'une prescription d'opiacés ne soient pas utilisés "comme prescrits" une fois à domicile alors que ces personnes étaient pourtant adéquatement soulagées avec un opiacé à l'hôpital mais à leur insu. Le seul fait d'entendre le mot "morphine" ou de lire "narcotique" sur la bouteille de prescription peut faire en sorte que certaines personnes puissent refuser de prendre leur médication. A l'hôpital, "le médicament" qu'on administrait était tout bonnement appelé "médicament contre la douleur" ou encore, on identifiait le médicament sous son nom commercial, chacun prenant bien soin de ne pas prononcer le mot "MORPHINE" ou "NARCOTIQUE" pour ne pas avoir à éveiller des soupçons, des questions ou des résistances.
Pas très honnête, à première vue, dans la façon de faire!
Imaginons un peu maintenant que cette "minime" tromperie, dans le mode d'usage, s'ajoute aux doutes projetés sur la personne qui a mal et qui ont cours durant le processus d'évaluation de la douleur !!! Doutes et tromperies: quelle élégante combinaison comme préliminaire aux interventions à visée analgésique !!!
Sixièmement,
il sera nécessaire d'aborder la douleur suivant une perspective de gestion globale et non pas uniquement de traitement, ceci afin d'inclure tous les moyens et toutes les interventions que l'approche multidisciplinaire peut offrir. On peut donc espérer que, de cette façon, l'approche devienne multidimensionnelle, et rejoigne ainsi les nombreux impacts de la maladie, c'est-à-dire la douleur "dans le corps" et la douleur "dans l'âme".
En effet il est bien connu que plusieurs types de douleur peuvent coexister chez une même personne. Or, les composantes non-physiques de la vie, que l'on regroupe habituellement sous le vocable "psycho-socio-spirituelles", modulent considérablement la douleur physique. Malheureusement, cette modulation se fait souvent dans le sens d'une intensification. Ce rehaussement de la douleur causé par les éléments non-physiques ne répond nullement aux opiacés et ne répondra pas même si on augmente la dose. Les opiacés n'ont pas d'effets anxiolytiques; ils sont des analgésiques.
Si on ne parvient pas à équilibrer notre gestion de la douleur grâce à une combinaison d'approches multidisciplinaires et multidimensionnelles, on risque de ne pas atteindre les objectifs fixés et, donc, de ne pas offrir l'analgésie souhaitée qu'il aurait été possible d'obtenir, si on s'était donné la peine de recourir à d'AUTRES moyens que la pharmacothérapie uniquement.
14 - Choix aléatoires, résultats aléatoires
Par le non-respect des éléments-clé de la maîtrise de la douleur, on risque de n'utiliser que l'approche pharmacologique. Pire encore serait de recourir à une démarche pharmacologique sans que le choix du ou des médicaments appropriés ne repose sur un fondement logique.
Les médicaments sont alors employés au gré du hasard, choisis subjectivement sous le coup d'une inspiration subite ou en raison d'une certaine aisance à manipuler préférentiellement tel ou tel médicament.
Dans une telle situation, l'interrogation, pour celui ou celle qui prescrit, s'arrête à un choix "aléatoire" parmi une simple liste de médicaments à peu près tous égaux, puisqu'aucun motif "rationnel" ne guide la prescription qui est faite. Pourtant, celui ou celle qui prescrit se trouve au centre d'un large arsenal de médicaments reconnus pour soulager la douleur mais avec des indications particulières pour chacun et le/les choix qu'il/elle fait parmi l'arsenal aurai(en)t donc dû reposer sur des critères rationnels au lieu de reposer sur des effets présomptifs ou sur la méthode "par tâtonnement". Le non-respect des éléments-clé de la maîtrise de la douleur risque donc de se faire au détriment de la personne qui a mal en ajoutant une kyrielle d'effets secondaires à l'absence de soulagement espéré.15 - La première partie de ce manuel expose ... les nécessaires éléments d'anatomophysiologie et de pathophysiologie
La première partie de ce manuel expose les nécessaires éléments d'anatomophysiologie et de pathophysiologie sur lesquels devraient reposer toute notre conduite ultérieure face aux douleurs.
De telles notions veulent fournir une base logique et rationnelle à la gestion des douleurs. Leurs détails anatomophysiologiques et pathophysiologiques devraient permettre de cerner les mécanismes en cause par lesquels chaque personne trouve mille et une façons, qui lui sont propres, d'exprimer ses douleurs.
16 - Douleurs physiques: prévalence
La douleur physique occupe une place centrale dans le contexte des soins palliatifs. Elle représente le premier objectif auquel il faut s'adresser.
Les cancers les plus fréquents sont malheureusement en même temps ceux qui sont responsables d'un taux très élevé de douleur. N'aurait-on pu souhaiter que les cancers les plus fréquents soient ceux donnant le moins de douleur! Il n'en est malheureusement pas ainsi!
La douleur peut se retrouver selon les études chez 60-80 % des personnes en soins palliatifs. Dure réalité, incontestablement, mais il est heureusement possible de venir en aide à un fort pourcentage de "ces personnes qui ont mal". C'est ce qu'une bonne évaluation devrait permettre.
17 - La douleur et son lexique
Le domaine de la douleur possède, comme tous les autres domaines de la santé, son jargon propre. Autour du thème de la "DOULEUR" existe tout un lexique de mots qui tentent de décrire, de façon spécifique, différentes structures, différentes présentations cliniques et différents concepts.
Parmi la nomenclature descriptive se retrouvent les termes suivants:
- nociception
- allodynie
- analgésie
- anesthésie
- hyperalgésie
- hyperesthésie
- hyperpathie
- paresthésie
- dysesthésie
- douleur neurogène ou neuropathique.
Il existe encore de nombreux autres termes appartenant au lexique de la douleur, mais ils n'ont pas été retenus en regard des objectifs de cette présente série.
18 - Douleur - nociception: définition
De simple figurant dans le vocabulaire quotidien, la "DOULEUR" est désignée dans le jargon des sciences de la santé par le mot "NOCICEPTION". Il existe bien sûr une définition spécifique de la douleur qui sera discuté un peu plus loin dans le présent document
La NOCICEPTION pour sa part peut être comprise comme la perception par le cerveau de l'influx électrique cheminant dans les fibres du réseau nerveux nociceptif (axones, nerfs, racines, tractus/faisceaux ascendants spinothalamique et autres) et transportant donc l'information "douleur". L'IASP définit la nociception de la façon suivante: (traduction libre)
"une énergie thermique ou mécanique potentiellement dommageable pour les tissus qui est exercée sur une fibre nerveuse spécialisée particulièrement A delta et C" (IASP - 1994). En fait, la nociception n'est rien d'autre qu'une perception sensitive parmi bien d'autres, tout comme le son, la vue, le goût, à la différence peut-être qu'elle est une perception toujours dérangeante, souvent même, extrêmement dérangeante. Ces différentes sensations (son, vue, goût) originent de récepteurs particuliers, oreille, oeil, papilles gustatives. Elles sont, chacune, véhiculées par une variété de fibres nerveuses du réseau sensitif. Ces fibres, chacune spécialisée dans le transport d'un type d'influx spécifique, arrivent vers des zones particulières du cerveau qui ont, comme fonction première, d'interpréter l'information électrique "particulière" qui leur est ainsi apportée.
Ainsi, l'ouïe pourrait être décrite comme la perception de l'activité électrique neuronale transportant l'information "son" vers le cerveau, ainsi la vue pour l'information "image" et le goût pour l'information "gustative".
Les récepteurs de la douleur s'appellent des NOCICEPTEURS.
19 - Un lexique "douloureux"
Les définitions proposées dans les lignes qui suivent sont celles retenues par le groupe de travail sur la taxonomie (Task Force on Taxonomy) de l'IASP et publiées en 1994. Elles sont une traduction libre de la version anglaise et contiennent une annotation complémentaire proposée à titre d'éclaircissement dans certains cas.
- ALLODYNIE
"douleur résultant d'un stimulus qui ne provoque habituellement pas de douleur".
Dans ce cas, la sensation douloureuse éprouvée ne possède aucun lien quelconque avec la stimulation provoquée comme lorsqu'une douleur est créée par le fait de toucher superficiellement une région. Le coup de soleil en est un bon exemple.- ANALGESIE
"absence de douleur en réponse à une stimulation qui devrait normalement être douloureuse".
- La définition puriste avance le concept d'"absence de douleur ..." mais en fait, l'analgésie, telle que vécue tous les jours, est habituellement la résultante de manoeuvres pharmacologiques ou autres appliquées sur une ou plusieurs composantes du réseau nociceptif et qui ont pour effet de réduire ou d'éliminer la sensation douloureuse ressentie par l'application de stimulus douloureux. On dit qu'une substance est analgésique ou encore qu'une technique ou une manoeuvre possède des effets analgésques.
- ANESTHESIE
"perte complète de toute sensibilité dans une région donnée".
Cette perte concerne toutes les sensibilités possible, le toucher léger, la piqûre, le sens du positionnement etc. On dit que la région est "gelée".- HYPERALGESIE
"une réponse augmentée (ou exagérée) à un stimulus douloureux".
- A la différence de l'allodynie, le stimulus, dans le cas de l'hyperalgésie, doit être douloureux au départ mais alors il existe une nette disproportion entre l'intensité du stimulus douloureux appliqué et l'intensité de douleur ressentie lors de l'application de ce même stimulus. Le stimulus douloureux n'aurait pas dû causer autant de douleur.
- HYPERESTHESIE
"sensibilité augmentée à tout type de stimulation (autre que douloureux) excluant cependant les sens spéciaux".
La sensation éprouvée est alors concordante avec la stimulation provoquée (par exemple gratter la peau avec les soies d'une brosse et ressentir la sensation de grattage) mais son intensité est nettement exagérée par rapport à l'intensité du stimulus. De plus, elle est ressentie comme normale i.e. qu'elle appartient à la gamme des sensations cutanées normales.
- Les sens spéciaux exclus dans la présente définition comprennent à titre d'exemple l'odorat, l'audition, la vue, le goûter.
- HYPERPATHIE
"un syndrome douloureux caractérisé par une réponse douloureuse nettement exagérée découlant de stimuli répétitifs, incluant en même temps une élévation de seuil".
Dans ce cas, la sensation douloureuse éprouvée peut découler d'une stimulation véritablement douloureuse ou d'une stimulation totalement indolore. Dans le contexte d'hyperpathie, la douleur éprouvée ne possède aucun lien quelconque ni avec le type de stimulation provoquée, ni dans le caractère de la douleur ressentie, ni dans l'étendue de cette même douleur. A ce titre, on peut comprendre l'hyperpathie comme étant la résultante d'une combinaison à la fois d'allodynie et d'hyperesthésie dans un contexte cependant où les stimulations ont été appliquées de façon répétées et soutenues. La répétition soutenue des stimulations entraîne une élévation progressive du seuil d'activation des "nocicepteurs" de sorte qu'il faut des stimuli (douloureux ou autres) de plus en plus intenses pour provoquer de la douleur mais lorsque ces stimuli finissent par provoquer de la douleur, cette douleur est infiniment intense et beaucoup plus étendue que ce à quoi on devrait s'y attendre. La douleur ressentie possède alors l'intensité d'une douleur explosive qui se propage parfois sur un grand territoire.- PARESTHESIE
"une sensation anormale (non-douloureuse), qu'elle soit spontanée ou provoquée".Cette sensation peut découler bien sûr d'un stimulus identifié mais en clinique elle découle souvent, à ses débuts, d'une origine "inapparente" comme dans le cas de lésions nerveuses qui vont finir par se révéler de façon plus probante avec le temps pour devenir même des douleurs neurogènes (ou neuropathiques).
Il est important de noter que pour qu'une sensation soit paresthésique, elle doit être différente des sensations dites "normales" qu'il est habituellement possible de provoquer. Ainsi, une sensation paresthésique peut être de type "fourmillements, picotements ou engourdissements", sensations qu'il n'est généralement pas possible de produire par stimulations, et en même temps être d'un niveau d'intensité "acceptable" i.e. non douloureux. Elle ne doit cependant pas être à ce point anormale et intense qu'elle devienne "désagréable ou déplaisante" car alors une autre nomenclature s'applique, cette paresthésie devient dysesthésie.
- DYSESTHESIE
"une sensation anormale "désagréable ou déplaisante", qu'elle soit spontanée ou provoquée".
Cette sensation peut découler bien sûr d'un stimulus identifié mais en clinique elle découle le plus souvent d'une origine "inapparente" comme dans le cas des douleurs provenant de lésions nerveuses (douleurs neurogènes ou neuropathiques).
Il est important de noter, tout comme pour la sensation paresthésique, que pour qu'une sensation soit dysesthésique, elle doit être différente des sensations dites "normales" qu'il est habituellement possible de provoquer et en même temps être d'un niveau d'intensité qualifié d'inacceptable. La sensation "dysesthésique" doit ainsi être à ce point anormale et intense qu'elle devienne "désagréable ou déplaisante". Ainsi, les fourmillements, picotements ou engourdissements deviendront d'une intensité inqualifiable. Les brulûres pour leur part deviendront "cuisantes" ou "comme des torches allumées". Rien de comparable donc avec l'intensité "paresthésique".- DOULEUR NEUROGENE OU NEUROPATHIQUE
"une douleur initiée ou causée par une lésion primaire, une dysfonction, ou une perturbation transitoire dans le système nerveux périphérique ou central".
Cette douleur résulte donc la plupart du temps d'une agression de quelque origine que ce soit (compression, traumatisme etc,) sur une ou des composantes du circuit nerveux nociceptif. Cette agression peut avoir eu lieu ou a lieu spécifiquement au moment où la douleur est ressentie. Dans les documents qui suivent, le terme "douleur neurogène" sera presque toujours celui utilisé.20 - La douleur: résumé anatomo-physiologique "simplifié" et "vulgarisé"
- des "récepteurs de la douleur" situés en périphérie. Ces récepteurs sont plus correctement appelés nocicepteurs, d'où l'expression "douleur nociceptive". La douleur ressentie par la piqûre d'une aiguille ou lors d'une entorse en sont des exemples.
- d'une région sur le neurone nociceptif (ou fibre nociceptive) où se déroule une agression mineure ou majeure ou encore d'une région sur le neurone nociceptif où une agression a définitivement créé une lésion. On parle alors de "douleur neurogène". L'inconfort ressenti sous forme de douleur-engourdissement-brûlure lorsqu'une jambe demeure longtemps croisée en est un exemple.
Les pages qui suivent ont pour objet d'expliciter ce bref résumé.
21 - Les récepteurs de la douleur: les nocicepteurs
Le modèle classique de la douleur débute avec la provocation d'un stimulus "douloureux" qui déclenche la production d'un influx "douloureux". Pour qu'il y ait influx douloureux, il faut d'abord que certains nerfs soient capables de reconnaître un stimulus nociceptif et c'est le fait des neurones nociceptifs. Ce stimulus douloureux n'est habituellement "reconnu" que par les extrémités des neurones nociceptifs, extrémités auxquelles on réfère comme étant des "terminaisons nerveuses". Chaque neurone "nociceptif" possède une abondance de terminaisons nerveuses un peu comme chaque branche d'un arbre possède de nombreuses ramifications.

ANIMATION 21.1 Ainsi est créée "la douleur nociceptive".
Les terminaisons nerveuses des neurones nociceptifs jouent le rôle de "senseurs" à la douleur. Ces "senseurs" aux stimuli douloureux sont qualifiés de récepteurs de la douleur et sont préférablement identifiés comme étant des nocicepteurs.
Les nocicepteurs sont en fait des "traducteurs" de signal puisqu'ils "traduisent" un certain type de signal (coup de marteau sur un pouce) en un autre type (influx électrique douloureux). Dans le jargon de la physique, on les qualifie de "transducteurs" et la traduction d'une sorte de signal en un autre s'appelle la "transduction".
Différents types de nocicepteurs existent malgré le fait que leur apparence anatomique soit identique, ils sont tous des terminaisons nerveuses dénudées de myéline, on les dit "terminaisons libres". Ils sont souvent classifiés selon leurs réponses à différents stimuli "douloureux". Certains ne répondent sélectivement qu'à une seule sorte de stimulus, d'autres répondent à divers types de stimuli.
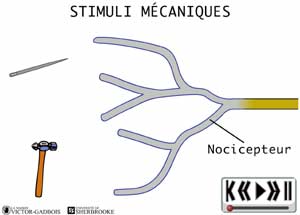
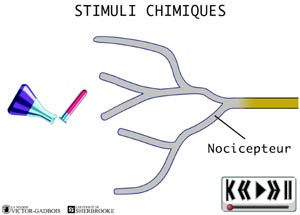
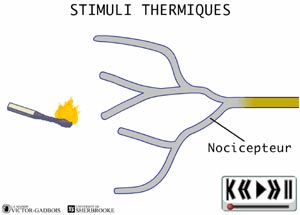
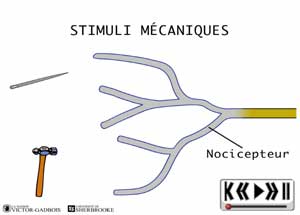
Les nocicepteurs peuvent répondre à trois types de stimuli:
- mécanique (pression, étirement)
ANIMATION 21.2 - thermique (chaud et froid)
ANIMATION 21.3 - chimique (des substances endogènes et exogènes).
ANIMATION 21.4
22 - Les différents types de nocicepteurs
Il reste étonnant de constater combien il est demeuré jusqu'à maintenant difficile, voire impossible, d'identifier, sur le plan histologique, des structures spécifiques faisant office de "récepteurs de la douleur" alors que de nombreux autres "détecteurs sensitifs ou senseurs" sont connus depuis fort longtemps. Les nocicepteurs semblent réussir à garder le secret de leur histologie, ils apparaissent tous comme des "terminaisons libres" alors que l'existence même de la douleur ne fait de doute pour personne ... sur cette terre.
Ils sont appelés "terminaisons libres" en raison du fait qu'ils ne possèdent aucun recouvrement d'aucun type, ni capsule, ni myéline. Cependant, un certain nombre de ces récepteurs, en l'occurence certains récepteurs polymodaux parmi ceux décrits dans les lignes qui suivent, peuvent être recouverts d'une très fine couche de myéline tellement négligeable pourtant que tous les nocicepteurs sont qualifiés de "terminaisons libres" i.e. non-myélinisées.
Les études sur la douleur se sont concentrées depuis longtemps sur les stimulations cutanées en raison, de toute évidence, de la facilité de provoquer des stimuli nociceptifs de divers ordres sur la peau.
La littérature actuelle reconnaît quatre principaux types de nocicepteurs au niveau cutané:
- les récepteurs sensibles à la pression, aussi appelés mécanosensibles ou MECANORECEPTEURS.
ANIMATION 22.1 Ces nocicepteurs produisent des influx "douloureux" dont la fréquence est proportionnelle à l'intensité de la pression ou de la tension exercée. Ils sont particulièrement sensibles aux stimulations par des objets pointus (aiguilles). En fait, ces mécanorécepteurs réagissent à des stimuli de faible intensité (aiguille vs marteau!). Ils sont qualifiés de récepteurs à bas seuil (low threshold) et sont connectés à une sorte de neurones ou fibres nociceptives, les fibres A delta. Ils ne sont présents que dans la peau.
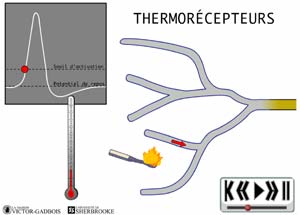
ANIMATION 22.2 - les récepteurs sensibles à la température, aussi appelés thermosensibles ou THERMORECEPTEURS.
ANIMATION 22.3 Ces nocicepteurs produisent des influx "douloureux" dont la fréquence est aussi proportionnelle à l'intensité du degré de stimulus thermique exercé. Ils sont qualifiés de récepteurs à bas seuil (low threshold). Ils sont connectés à une ou l'autre des deux sortes de fibres nociceptives, les fibres A delta ou C. Les fibres C des thermorécepteurs ne conduisent que les influx provenant de ces mêmes thermorécepteurs. Elles ne conduisent pas les influx provenant des autres types de nocicepteurs. Ainsi, les fibres C branchées aux thermorécepteurs ne possèdent pas de branchements avec les autres récepteurs mécanothermiques et polymodaux. En fait, les fibres C ne sont donc jamais connectées en même temps à divers types de nocicepteurs.
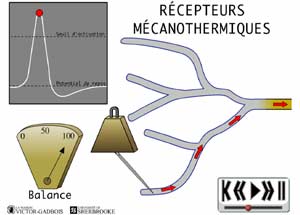
ANIMATION 22.4 - les récepteurs sensibles à la pression et à la température, aussi appelés RECEPTEURS MECANOTHERMIQUES.
ANIMATION 22.5 Ces nocicepteurs ne produisent des influx "douloureux" qu'à la suite de fortes intensités de pression ou de température exercées. Ils sont des récepteurs à seuil élevé ou à haut seuil d'activation (high threshold) parce que seule une forte stimulation nociceptive peut déclencher un influx douloureux. Ils sont préférentiellement connectés à des fibres C qui encore leurs sont propres.
ANIMATION 22.6 - les RECEPTEURS POLYMODAUX ... les plus abondants parmi tous les nocicepteurs
ANIMATION 22.7 Ces nocicepteurs produisent des influx "douloureux" en réponse à différents types de stimuli exercés: pression/étirement, température, substances chimiques. Ils sont responsables du caractère de brûlure et/ou d'élancement des douleurs, de la localisation "vague, diffuse et imprécise" de ces mêmes douleurs tout comme du degré d'intensité décrit comme "intolérable ou désagréable" . Ils nécessitent des stimulations "fortes" pour être activés. Ils sont les nocicepteurs au seuil le plus élevé d'activation qui soit (high threshold). En fait , ils sont les derniers à réagir dans l'échelle d'intensité des stimuli douloureux.
ANIMATION 22.8 La très très grande majorité des récepteurs polymodaux sont connectée à des fibres C. Un petit nombre de ces mêmes récepteurs sont aussi connectés à des fibres A delta, ils peuvent alors être recouvert d'une couche négligeable de myéline tel que mentionnné ci-haut.
Parmi tous les nocicepteurs énumérés, les récepteurs polymodaux représentent plus de 75-80 % de tous les nocicepteurs. C'est dont dire l'importance de la contribution des nocicepteurs polymodaux dans la perception de la douleur et l'importance de la conduction nociceptive par les fibres C qui leur sont "branchées".
En dehors des structures cutanées, les récepteurs polymodaux prédominent partout de façon écrasante puisqu'ils constituent l'exclusivité presque totale parmi les récepteurs nociceptifs au niveau de toutes les structures viscérales. On les retrouve presque partout dans les viscères, ils savent réagir à l'ensemble des différents stimuli pouvant causer de la douleur dans les viscères: l'étirement et la compression figurent parmi les exemples de stimuli mécaniques, l'ischémie et l'inflammation pour les stimuli chimiques. Les stimuli thermiques ne causent pas de douleur à l'intérieur des viscères, à titre d'exemple, l'oesophage et l'estomac ne renvoient pas de sensations douloureuses lorsque des liquides/aliments très chauds sont ingérés, tout au plus ressent-on une certaine sensation de chaleur mais qui n'est pas de la douleur. La bouche pour sa part répond par de la douleur aux stimulations provoquées par des aliments très chauds.
Enfin, certaines structures, reconnues pour être "sans pardon" quant à leur capacité de générer des douleurs, ne sont pourvues que de récepteurs polymodaux (terminaisons libres). Ces structures figurent au nombre de trois, ce sont:La moindre "poussière cornéenne" représente un "enfer", quand au "mal de dent", cette entité est passé à l'histoire depuis la nuit des temps. Pour ce qui est du "mal d'oreille", nos parents peuvent nous raconter combien cela a pu "raccourcir" certaines de leurs nuits et nous comme parents pouvons en dire autant. Après ces trois exemples de "calamités douloureuses", il est difficile de demeurer incrédule face au rôle des récepteurs polymodaux (terminaisons libres) et des fibres C dans la genèse des pires douleurs.
Les terminaisons libres se terminent comme de fins embranchements multiétalés. Chaque terminaison libre recouvre une portion de plusieurs autres de sorte qu'il existe un important chevauchement de plusieurs terminaisons libres dans un centimètre cube de tissu innervé.
- la cornée,
- la pulpe dentaire
- le tympan.
23 - Les nocicepteurs: leurs localisations
- la surface cutanée répond aux stimuli
• mécaniques • thermiques • chimiques (exogènes et endogènes)
Elle est donc pourvue de récepteurs
• mécanorécepteurs • thermorécepteurs • récepteurs mécanothermiques
• récepteurs polymodaux
- les muscles squelettiques répondent particulièrement à des stimuli
• chimiques (exogènes et endogènes)
- Dans un tel contexte, ce sont des substances produites en contexte d'hypoxie ou d'anaérobie relative (par exemple de l'acide lactique) qui font office de stimulants chimiques endogènes.
Ils sont donc pourvus de
• récepteurs polymodaux réagissant à différentes substances chimiques (acide lactique)
- le muscle cardiaque répond à des stimuli
• mécaniques • thermiques • chimiques (à ce niveau, c'est l'hypoxie qui joue un rôle déclenchant et qui entraîne la production d'acide lactique, de prostaglandines, histamine, bradykinine, sérotonine)
Il est pourvu de
• mécanorécepteurs • thermorécepteurs • récepteurs polymodaux réagissant à différentes substances chimiques découlant de l'hypoxie (acide lactique, prostaglandines, histamine, bradykinine, sérotonine). Ces différents nocicepteurs sont presque exclusivement connectées à des fibres C.
- les articulations répondent à des stimuli
• mécaniques • chimiques (à ce niveau, c'est l'inflammation qui joue le rôle déclenchant et qui entraîne la production de prostaglandines, histamine, bradykinine, sérotonine) Elles sont pourvues de
• mécanorécepteurs • récepteurs polymodaux réagissant à différentes substances chimiques découlant de l'inflammation (prostaglandines, histamine, bradykinine, sérotonine).
- le périoste répond à des stimuli
• mécaniques • chimiques (à ce niveau, c'est l'inflammation qui joue le rôle déclenchant et qui entraîne la production de prostaglandines, histamine, bradykinine, sérotonine) Il est pourvu de
• mécanorécepteurs • récepteurs polymodaux réagissant à différentes substances chimiques découlant de l'inflammation (prostaglandines, histamine, bradykinine, sérotonine).
- les viscères répondent à des stimuli
• mécanorécepteurs • thermorécepteurs • récepteurs polymodaux réagissant à différentes substances chimiques découlant de l'hypoxie (acide lactique, prostaglandines, histamine, bradykinine, sérotonine). Ces différents nocicepteurs sont presque exclusivement connectées à des fibres C.
Ils sont pourvus de
• mécanorécepteurs • thermorécepteurs • récepteurs polymodaux réagissant à différentes substances chimiques découlant de l'hypoxie (acide lactique, prostaglandines, histamine, bradykinine, sérotonine). Ces différents nocicepteurs sont presque exclusivement connectées à des fibres C.
- les vaisseaux sanguins répondent à des stimuli
• mécaniques • chimiques (à ce niveau, c'est l'inflammation qui joue le rôle déclenchant et qui entraîne la production de prostaglandines, histamine, bradykinine, sérotonine) Ils sont pourvus de
• mécanorécepteurs • récepteurs polymodaux réagissant à différentes substances chimiques découlant de l'inflammation et l'hypoxie (prostaglandines, histamine, bradykinine, sérotonine). Ces différents nocicepteurs sont presque exclusivement connectées à des fibres C. De nombreuses autres structures sont pourvues de nocicepteurs, l'énumération actuelle des exemples a été choisi en raison de la haute prévalence de douleurs dans ces différentes structures. Les dernières structures proposées sont souvent oubliés, il ne faut pourtant pas oublier que les douleurs "vasculaires" existent bel et bien en raison de la présence de nocicepteurs à la surface des vaisseaux sanguins.
Même si on retrouve des nocicepteurs en grand nombre dans de très nombreuses structures anatomiques, les nocicepteurs ne sont pas présents partout. A titre d'exemple, le cortex cérébral n'est pas doté de nocicepteurs, le poumon est dépourvu de nocicepteurs tout comme le foie, la paroi intestinale est insensible aux pinces que le chirurgien applique et l'intérieur de la cavité utérine n'est pas non plus sensible lors des curetages utérins.
Les nocicepteurs, peu en importe le type, ont donc comme fonction de "traduire" différents modes de signaux en des signaux "électriques".
Cette transduction d'une sorte de stimulation en signaux électriques est induite par des changements observables et mesurables au niveau des charges électriques réparties de chaque côté de la membrane du neurone (membrane neuronale). On réfère à ce phénomène de changements des charges électriques de part et d'autre de la membrane comme étant une dépolarisation membranaire.
24 - Les autres informations sensitives et leurs récepteurs
D'autres informations sensitives en provenance des structures somatiques (peau, système musculo-squelettique) existent. Ces informations ne sont pas dérangeantes cependant. Elles relèvent, elles aussi, de récepteurs divers qui, eux, ne sont pas sensibles i.e. ne réagissent pas aux stimulations douloureuses. Cependant lorsque leur stimulation devient très intense, ces récepteurs peuvent alors transmettre des influx à tonalité nociceptive et contribuer ainsi à l'amplification des messages douloureux arrivant à la moelle.
Parmi les informations sensitives non-nociceptives, figurent:
- la proprioception consciente i.e. la discrimination tactile (discrimination deux points), le sens de la position, le sens de vibration ainsi que la proprioception inconsciente
et- le toucher léger superficiel.
Ces deux grands types d'information originent de récepteurs histologiquement fort différents les uns des autres et sont acheminés vers les centres supérieurs par des circuits ou faisceaux différents.
La discrimination tactile et la proprioception proviennent de récepteurs qui informent sur:
- le degré d'étirement musculaire (information kinesthésique)
- l'angle de positionnement d'une articulation (information kinesthésique)
- le mouvement d'une articulation (information kinesthésique)
- la rapidité de mouvement d'une articulation (information kinesthésique)
- les stimulations cutanées vibratiles (sens de la vibration)
- la discrimination tactile (discrimination deux points)
- la discrimination tactile complexe discriminative (par exemple identifier une pièce de monnaie dans la main)
- le sens de la position, le sens de vibration
- le degré de pression subi par la surface cutanée.
Ces informations sont obtenues grâce à différents récepteurs "encapsulés" (donc fort différents des terminaisons libres) parmi lesquels figurent:
- les fuseaux musculaires (muscle spindles). Les fuseaux neuromusculaires sont disposés entre les fibres musculaires des muscles striés.
- les organes tendineux de Golgi (Golgi tendon organ). Les organes tendineux de Golgi sont situés aux jonctions musculo-tendineuses.
- les récepteurs ou corpuscules de Ruffini. Ces récepteurs sont situés à différents endroits, dans le tissu conjonctif du derme profond où ils sont sensibles sensibles à la pression et à l'étirement de la peau, au niveau des capsules articulaires où ils sont profondément ancrés aux ligaments. Au niveau des articulations, ils représentent la majorité des récepteurs articulaires. Ils participent aussi aux sensibilités thermiques du chaud par leur présence dans le derme profond.
- les corpuscules de Krause. Ces récepteurs situés sous la couche basale de l'épiderme participent à la sensibilité thermique du froid.
- les corpuscules de Pacini (Pacinian corpuscles). Les corpuscules de Pacini se retrouvent dans le tissu adipeux et le tissu conjonctif sous-cutané du derme ainsi que dans les tendons et les régions articulaires. Ces récepteurs sont particulièrement sensibles aux moindres vibrations et à toute déformation cutanée de l'ordre du nanomètre, ils ont ainsi une extrême sensibilité à détecter tout mouvement de l'ordre de quelques nanomètres et à filtrer tout stimulus de basse fréquence.
- les disques de Merkel. Ces récepteurs sont situés dans la couche profonde de l'épiderme particulièrement dans le bout des doigts. Ils sont responsables de la perception de la forme et de la texture en raison de leur extrême sensibilité aux stimulations provenant de pointes, d'arêtes et de courbure et de leur discrimination spatiale très marquée de l'ordre de 0.5 mm.
- les corpuscules de Meissner (Meissner's corpuscles) sont situés immédiatement sous l'épiderme dans les papilles dermiques. Ces récepteurs participent au toucher superficiel complexe. On les retrouve particulièrement au niveau de la paume de la main, de la plante du pied et des organes génitaux.
- et d'autres récepteurs encapsulés qui se retrouvent dans les muscles, les tendons, les ligaments, les articulations, au pourtour des racines des poils et dans la peau.
Ces différents récepteurs qui informent sur la localisation spatiale et sur la perception de la taille et de la forme d'un objet, sont connectés à des grosses fibres nerveuses (A alpha et A bêta) qui forment leur propre réseau ou faisceau lors de l'ascension de ces informations par les cordons postérieurs vers le cerveau, A partir des étages du tronc cérébral, ces informations sont véhiculées par le réseau lemniscal qui fait son ascension vers le thalamus.
Presque tous ces récepteurs peuvent, à stimulation intense, générer des influx à tonalité nociceptive. Ainsi à titre d'exemple, malgré son encapsulement en pelure d'oignon, le corpuscule de Pacini peut générer de la douleur lorsqu'il est soumis à de fortes pressions.
Le toucher léger superficiel provient pour sa part de récepteurs (corpuscules de Meissner et de Merkel) la sensibilité tactile superficielle qui informent:
- sur la sensibilité tactile superficielle i.e. le contact léger superficiel avec la peau originant
- d'un très léger effleurement
- d'une très légère pression.
- sur la localisation de cette fine stimulation mais cette information, transmise par les récepteurs du toucher léger superficiel le serait de façon "vague et imprécise" si ce n'était de la participation des récepteurs proprioceptifs.
Les récepteurs qui informent sur le contact léger superficiel avec la peau et la localisation spatiale "vague et imprécise" sont connectés à des fibres nerveuses de petits calibres, les fibres A delta, qui forment elles aussi leur propre réseau lors de l'ascension de ces informations vers le cerveau.
Les informations du toucher léger superficiel sont ainsi acheminées elles aussi par des fibres qui lui sont spécifiques. Ces fibres cheminent à travers celles du réseau néo-spinothalamique qui est celui qu'empruntera une partie des informations nociceptives dans leur ascension vers les centres supérieurs. Plus d'un types d'information seront donc transportés dans ce réseau (Voir: LE SYSTEME DE TRANSPORT DES INFLUX NOCICEPTIFS: LA PORTION CENTRALE D'ORIGINE MEDULLAIRE).
25 - Le phénomène de dépolarisation "membranaire" et le seuil d'activation
Le processus de dépolarisation membranaire se déroulant au moment de la transduction d'un type quelconque de stimulation en signal électrique tel qu'introduit plus avant (Voir: LES NOCICEPTEURS: LEURS LOCALISATIONS) revêt une importance fondamentale puisqu'il touche l'essence même du mécanisme physiologique à l'origine de tout influx électrique dans un neurone et donc de tout influx douloureux. Par ailleurs, il est non seulement fondamental pour comprendre la "naissance" d'un influx douloureux mais il est aussi à la base des effets pharmacologiques de plusieurs médicaments utilisés en visée co-analgésique parmi lesquels se retrouve les anticonvulsivants et les antiarythmiques. Ces notions seront abordées dans le manuel III de la présente série (La gestion analgésique avec les co-analgésiques).
Qu'en est-il donc du processus de dépolarisation membranaire?
À l'état normal, toute cellule vivante est porteuse d'une charge électrique qui est différente de la charge électrique présente dans son environnement. Cette différence entre ces deux charges électriques, intra et extra cellulaire, peut être mesurée par un voltmètre. A l'état normal, cette lecture indique une charge positive pour l'environnement extra-cellulaire et une charge négative pour l'intérieur de la cellule. Cette différence de charges électriques s'observe de part et d'autre de la membrane cellulaire qui sépare, dans les faits, les milieux extra et intra cellulaires.
Cette différence de charges électriques se définit comme étant une polarisation, on dit alors que la membrane cellulaire (neuronale ou axonale dans le cas présent) est polarisée. Cette polarisation concerne classiquement deux électrolytes, le sodium (Na+) et le potassium (K+). Le Ca++ et le Cl- jouent aussi un rôle mais plus tardivement dans la génération d'un influx. La polarisation s'explique par le fait que la concentration en ions sodiques, Na+, est plus élevée à l'extérieur de la cellule qu'à l'intérieur de celle-ci. Les ions potassiques, K+, se retrouvent en plus grande concentration à l'intérieur de la cellule qu'à l'extérieur mais ne font pas le contrepoids avec les ions Na+ pour ce qui concerne les charges électriques étant donnée l'importante différence quantitative en faveur des ions Na+.
En situation de repos, la polarisation i.e. le potentiel de repos, découlant de la différence de charge ionique de part et d'autre de la membrane neuronale s'exprime en millivolts (mV). Comme la charge intérieure est négative, la polarisation est exprimée en valeur négative. Par exemple, il est ainsi fréquent de rencontrer des charges de - 40 mV à - 60 mV (moins 40 à moins 60 mV) pour une cellule.
Quant survient une stimulation des nocicepteurs (ou de toute structure neuronale: axone, dendrite), on observe alors une augmentation de la perméabilité de la membrane neuronale dans la région de la stimulation. Les ions sodiques Na+ qui se trouvent en abondance à l'extérieur de la cellule commencent à se déverser à l'intérieur de la cellule par des ouvertures déjà toutes créées dans les membranes cellulaires mais qui sont fermées en situation de repos i.e. lors du potentiel de repos. Ces ouvertures correspondent à des structures anatomiques spécifiques auxquelles on réfère sous le nom de "canaux ioniques" (Voir: LES DIFFERENTS "CANAUX IONIQUES"). Ce phénomène s'accompagne en même temps d'un certain mouvement des ions potassiques K+ qui sont alors évacués vers l'extérieur de la cellule par le biais de certains canaux ioniques spécifiques K+. Les charges électriques de part et d'autre de la membrane cellulaire connaissent dès lors une inversion au point où les charges négatives tendent à se positiver, à titre d'exemple les charges auront tendance à évoluer vers -30, -12, -4, + 6. Ce phénomène d'inversion des charges porte de nom de "dépolarisation". L'ouverture rapide de certains canaux ioniques spécifiques K+est là pour protéger au début de toute stimulation dont l'intensité pourrait être nociceptive afin que la dépolarisation ne se produise pas trop rapidement.
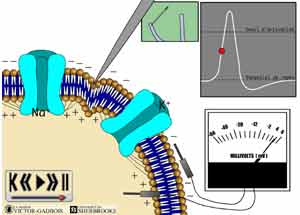
ANIMATION 25.1
Lorsque la dépolarisation commence à se produire, l'influx nociceptif n'est pas encore créé. Il faudra que la dépolarisation atteigne un certain voltage transmembranaire pour que d'autres canaux inoniques Na+ (les canaux voltage dépendants) différents des premiers et tout particulièrement les canaux Ca++ s'ouvrent soudainement afin de laisser entrer une quantité élevée d'ions Na+ et Ca++ qui s'ajouteront aux ions Na+ déjà présents, ce qui aura pour effet de créer enfin le potentiel d'action i.e. l'influx nociceptif.
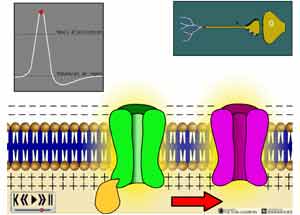
ANIMATION 25.2 La valeur du voltage transmembranaire devant être atteint pour provoquer l'ouverture des canaux "voltage dépendants" correspond au "seuil d'activation". Il est important de noter que le seuil d'activation n'est pas fixe pour une terminaison nociceptive donnée, cette valeur du seuil d'activation peut augmenter ou diminuer selon certaines circonstances et selon l'environnement biochimique dans lequel les nocicepteurs se trouvent suite à certaines stimulations nociceptives (coup de soleil vs oedème par entorse).
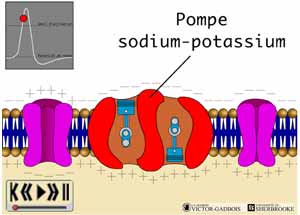
Après la création d'un influx, les canaux Na+ et Ca++ se referment rapidement, les pompes Na-K s'activent de façon plus importante pour retourner le Na+ vers l'extérieur de la cellule et du K+ vers l'intérieur (3 Na+ pour 2 K+) et en même temps, certains canaux K+ spécifiques à la repolarisation et différents des premiers s'ouvrent de façon transitoire pour permettre au K+ de revenir à l'intérieur de la cellule. Cet ensemble de processus vise à rétablir rapidement le potentiel transmembranaire de repos. C'est le phénomène de repolarisation.
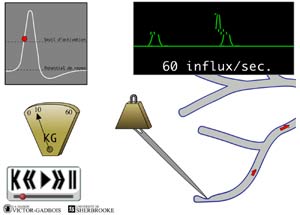
ANIMATION 25.3 Dans le cas des nocicepteurs, la stimulation nociceptive soutenue entrainera un train d'influx nociceptif à une fréquence donnée. En fait, les nocicepteurs ont cette double capacité d'adapter leur seuil d'activation à l'intensité du stimulus nociceptif et d'adapter ainsi leur fréquence de décharges (firing rate) à l'intensité du stimulus nociceptif bien que cette capacité soit beaucoup plus lente que celle des récepteurs non nociceptifs (fuseaux musculaires (muscle spindles), organes tendineux de Golgi (Golgi tendon organ), récepteurs spécialisés dans les tendons, les ligaments et les articulations, corpuscules de Pacini (Pacinian corpuscles), corpuscules de Meissner (Meissner's corpuscles), corpuscules de Ruffini et disques de Merkel). Ainsi, à une certaine intensité de stimulus, tel neurone nociceptif produira 60 influx par secondes alors qu'à six fois cette intensité, le même neurone produira plus d'influx mais l'augmentation n'aura pas été proportionnelle, il ne produira, à titre d'exemple, que 100 influx par secondes. Le seuil d'activation pour créer un seul influx et celui pour créer une salve de 100 influx par secondes n'est pas le même, il s'est élevé considérablement dans le second cas sinon, l'augmentation aurait été proportionnelle.
ANIMATION 25.4 Dans le cas des fibres dont les terminaisons sont munies de nocicepteurs, l'influx ou le courant électrique ainsi créé transporte une information qui sera interprétée par le cerveau comme un message douloureux. On réfère à ce type de fibres comme étant des "fibres nociceptives" et on appelle ce type de transmission orientée vers le cerveau une "afférence" nociceptive. En contrepartie, les fibres motrices sont des "efférences".
26 - Les différents "canaux ioniques"
Plusieurs types de "canaux ioniques" existent, les quatre principaux sont les canaux:
- sodiques (Na+),
- potassiques (K+),
- chloriques (Cl-)
et- calciques (Ca++).
Certains canaux sont spécifiques pour un ion donné mais plusieurs canaux permettent le passage de plus d'une sorte d'ion.
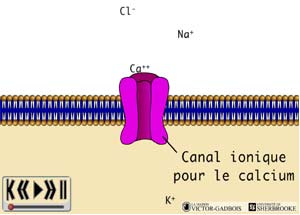
ANIMATION 26.1
Les "canaux sodiques" et les "canaux calciques" jouent un rôle majeur dans les phénomènes de dépolarisation membranaire.
Les canaux ioniques répondent i.e. vont s'ouvrir pour laisser passer des ions à la suite de trois types de stimulation:
- une stimulation "mécanique" qui a comme effet d'entrainer l'ouverture de certains canaux suite à l'étirement de la membrane. Ce sont les canaux "tension dépendants" [stretch activated]. La base de ces canaux est attachée au cytosquelette (à la membrane cellulaire) par des fines microfibrilles qui se comportent un peu comme les cordes de parachute qui lors de la mise en tension permettent au parachute de s'ouvrir, la mise sous tension de ces microfibrilles suite à l'étirement membranaire provoque l'ouverture de ces canaux,
- une stimulation "chimique" qui peut provenir d'un neurotransmetteur, d'un médicament (Voir: LA CORNE POSTERIEURE: UNE "COUR DE TRIAGE" COMPLEXE) ou encore d'une substance intracellulaire. Ce sont les canaux "médiateurs dépendants".
- une stimulation "électrique" qui correspond en fait à l'atteinte d'un certain voltage transmembranaire dans leur voisinage immédiat. Ce sont les canaux "voltage dépendants". Ces canaux vont "attendre" qu'un certain voltage transmembranaire qui leur est spécifique ait été atteint avant de s'ouvrir. L'atteinte de "ce certain voltage transmembranaire" découle de l'ouverture au préalable d'un certain nombre de canaux ioniques "médiateurs dépendants".
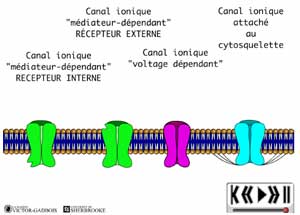
ANIMATION 26.2
A la différence des autres canaux ioniques, les canaux "voltage dépendants", lorsqu'ils s'ouvrent, permettent habituellement une entrée ou une sortie massive d'ions. Dans bon nombre de cas, la valeur de ce voltage transmembranaire spécifique correspond au seuil d'activation i.e. à la valeur du potentiel transmembranaire qui perment la création d'un influx électrique.La différence de concentration d'un bord et de l'autre de la membrane cellulaire fixe la contribution que chaque ion peut apporter dans l'accentuation ou la réduction du potentiel transmembranaire. Ainsi selon le type de cellule:
- l'ion Na+ peut contribuer pour + 40 à + 60 mV,
- l'ion Ca++ peut contribuer pour + 60 à + 240 mV,
- l'ion K+ peut contribuer pour - 80 mV,
alors que- l'ion Cl- peut contribuer tout au plus pour - 20 à - 60 mV.
C'est donc dire combien les canaux sodiques et calciques sont importants dans la production des influx de tout type.
Il existe aussi une autre forme de canaux ioniques qui a comme particularité de fonctionner à l'envers des canaux ioniques, ce sont les pompes Na-K. A l'inverse des canaux ioniques, les pompes Na-K travaillent à contre-courant en retournant de façon continue les ions là où ils sont en plus grande concentration donc en maintenant des concentrations inégales d'ions de part et d'autre de la membrane cellulaire et en participant aux mécanismes de repolarisation. Les pompes Na-K sont en fait des canaux ioniques particuliers fonctionnant à très haute consommation d'énergie. Dans les neurones excitables, jusqu'à 70% de l'énergie cellulaire est utilisé par la pompe Na-K qui est en fait un enzyme de type ATPase pour créer et maintenir une concentration très inégale des ions Na+ et K+ à travers la membrane cellulaire. Les pompes retournent plus de Na+ vers l'extérieur de la cellule que de K+ vers l'intérieur (3 Na+ pour 2 K+) c'est ce qui engendre le potentiel transmembranaire de repos et la charge négative intracellulaire puisque beaucoup plus d'ions Na+ se retrouvent à l'extérieur qu'à l'intérieur de la cellule.
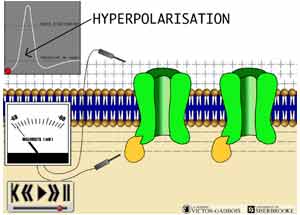
27 - Le phénomène d'hyperpolarisation "membranaire"
Certaines situations particulières peuvent faire en sorte qu'une cellule subisse une augmentation de sa charge négative au lieu d'une réduction (dépolarisation), on dit alors qu'elle est hyperpolarisée. En situation d'hyperpolarisation, le gradient de voltage transmembranaire devient plus important que lors du potentiel de repos, il peut ainsi devenir - 65 mV par exemple alors qu'il était - 40 mV au repos.
ANIMATION 27.1
Le phénomène d'hyperpolarisation provient pour sa part d'une ouverture des canaux chloriques (Cl-) et des canaux potassiques (K+) de façon concomitante. L'ouverture des canaux chloriques (Cl-) entraîne une migration des ions Cl- vers l'intérieur de la cellule, ce qui a pour effet d'accentuer la charge négative intracellulaire. Cette accentuation n'est pas très importante étant donné la faible contribution que l'ion Cl- peut offrir à ce titre. En même temps, l'ouverture des canaux potassiques (K+) permet au K+ de migrer vers l'extérieur ce qui vient encore accentuer la charge négative intracellulaire et donc l'hyperpolarisation. La contribution des ions K+ est plus importante que celle des ions Cl-.
L'hyperpolarisation joue un rôle particulier dans deux situations tout particulièrement:
- lors du phénomène de repolarisation alors que les canaux K+ spécifiques à la repolarisation peuvent demeurer ouverts de façon prolongée provoquant ainsi une période réfractaire post activation ce qui a pour effet de retarder la génération du prochain influx,
- lors de l'usage des opiacés qui ont pour effet d'entrainer l'ouverture de certains canaux K+ spécifiques. Cette ouverture provoque alors une hyperpolarisation régionale de la membrane réduisant ainsi considérablement les chances que le seuil d'activation ne soit atteint lorsqu'un influx nociceptif arrivera dans cette région puisque la valeur du voltage transmembranaire se trouve donc encore plus "négativée". (Voir: LA TRANSMISSION D'UN INFLUX DANS L'ESPACE SYNAPTIQUE: LES NTs "INHIBITEURS", L'HYPERPOLARISATION ET LES EFFETS SUR LE BOUTON PRE-SYNAPTIQUE ET LE NEURONE CENTRAL / LES RECEPTEURS OPIACES CENTRAUX: LES EFFETS PRODUITS PAR LEUR STIMULATION AU NIVEAU MEDULLAIRE)
28 - Le phénomène de sensibilisation
Deux caractéristiques électrophysiologiques très particulières des nocicepteurs ont été discutés jusqu'à maintenant:
- un seuil de dépolarisation élevé pour les stimuli naturels en comparaison des autres types de récepteurs dans le même milieu. Ceci fait en sorte que les stimuli normaux i.e. "non douloureux" comme le fait de toucher la peau ne puisse pas provoquer de douleur en temps normal. Cette caractéristique découle de la participation de certains canaux K+ spécifiques et du seuil d'activation relativement élevé des nocicepteurs,
- une tendance à augmenter leur fréquence d'influx suite à un stimulus douloureux prolongé i.e. produire de plus en plus d'influx douloureux en contexte de situations "agressantes" particulières sans pour autant le faire de façon proportionnelle (Voir: LE PHENOMENE DE DEPOLARISATION "MEMBRANAIRE" ET LE SEUIL D'ACTIVATION). Deux de ces circonstances "agressantes" sont connues depuis longtemps en recherche clinique
- les stimuli répétitifs
- les stimuli de plus en plus élevés en intensité.
C'est donc dire que les nocicepteurs prennent un certain temps avant de commencer à réagir mais qu'une fois la production d'influx débutée, ils ont la capacité d'augmenter leur fréquence d'activation suite à des stimuli répétitifs ou suite à des stimuli de plus en plus intenses.
En fait, les nocicepteurs savent faire preuve d'adaptation mais d'une adaptation qui n'est pas toujours au bénéfice de la personne qui a mal. Ainsi, les nocicepteurs peuvent voir leur seuil d'activation s'abaisser pour la peine en certaines situations rendant du même coup leur activation plus facile. Dans ces circonstances, même leur réponse en terme de fréquence d'influx peut se trouver en même temps augmentée. Cet abaissement du seuil d'activation peut même conduire à ce qui semble être une activité spontanée i.e. une activation spontanée, donc à la création d'influx nociceptif spontanés sans stimulations douloureuses évidentes.
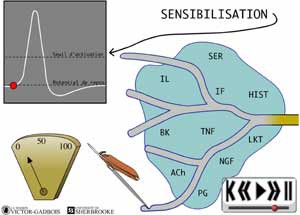
ANIMATION 28.1
Cet ensemble de phénomènes porte le nom de "sensibilisation" et sera illustré plus loin sur la base des mécanismes inflammatoires menant à la présence des substances "algogènes" dans les régions "lésées". (Voir: L'ACTIVATION "PRIMAIRE": ACTIVATION ET SENSIBILISATION DES NOCICEPTEURS)
La fatigue chez les humains joue un peu ce rôle de sensibilisation puisqu'alors l'intolérance, les sauts d'humeur, les colères impulsives sont à risque d'éclater au moindre stimulus irritatif qui survient. Le phénomène de sensibilisation ne s'arrête donc pas avec les nocicepteurs! On dit alors que le seuil de tolérance est abaissé et quand la colère éclate, elle est souvent d'intensité et de durée au-delà de la norme usuelle, il en est ainsi pour les nocicepteurs.
Dans d'autres circonstances, suite à des stimuli répétitifs de plus en plus élevés en intensité, l'adaptation se fera par une élévation considérable du seuil d'activation. Il faudra alors des stimuli nociceptifs beaucoup plus intenses qu'à l'habitude (suprathreshold stimuli) pour atteindre le nouveau seuil d'activation. Les conséquences cliniques de ces changements seront néfastes de nouveau pour la personne qui a mal (Voir: HYPERPATHIE DANS: UN LEXIQUE "DOULOUREUX" ). On ne parlera pas alors de sensibilisation mais d'adaptation des nocicepteurs.
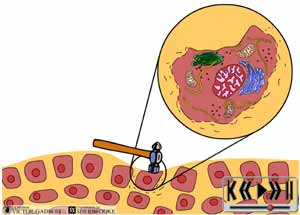
29 - Le caractère "agressant" des différents stimuli "douloureux" et la production de substances inflammatoires
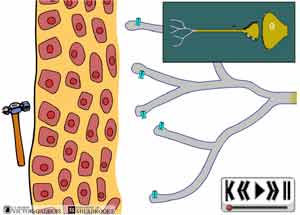
30 - L'activation "primaire"
Les premiers influx nociceptifs apparus à la suite de l'événement agressant commencent alors à se propager dans les fibres nociceptives. Une très large portion de ces influx se déplace "vers le cerveau" i.e. dans une direction "dromique" et la douleur commence alors à être ressentie, l'activation primaire des nocicepteurs a ainsi eu lieu.
Cependant, après avoir cheminé dans la fibre nociceptive dans la direction "dromique" i..e dans la direction attendue, une portion des premiers influx nociceptifs ainsi créée par l'événement agressant change de direction. Ces influx "inversés" se dirigent alors vers les premiers sites d'embranchements des terminaisons nerveuses pour se rendre finalement jusqu'à la complète périphérie i.e. vers la partie la plus distale des terminaisons où ils viennent se terminer, on parle alors d'une orientation "antidromique".
Ces influx "antidromiques" provoquent
- la migration de vésicules de substances P vers les extrémités périphériques des terminaisons nerveuses "nociceptives"
- la libération de substance P dans les tissus environnants.
ANIMATION 30.1 Cette substance, contenue dans de fines vésicules au niveau des terminaisons nerveuses fait l'objet d'un transport actif dans les fibres nociceptives puisqu'on son site de production se trouve à l'autre bout de la fibre nociceptive, là où se trouve le noyau des neurones nociceptifs, où elle joue encore un rôle important dans le relais des influx nociceptifs entre les deux fibres nociceptives périphériques et centrales. (Voir: LA CORNE POSTERIEURE: UNE "COUR DE TRIAGE" COMPLEXE).
ANIMATION 30.2 Dès leur production, les prostaglandines augmentent de façon considérable la sensibilité des différentes terminaisons nerveuses à la bradykinine. En peu de temps, les autres substances inflammatoires dites "algogènes" commencent déjà à s'accumuler.
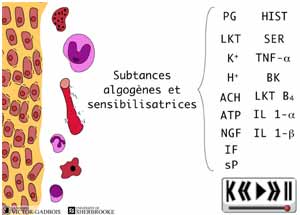
ANIMATION 30.3 En peu de temps, se retrouvent donc, dans un même environnement, une "redoutable" famille de substances inflammatoires "algogènes" parmi lesquelles figurent tout particulièrement:
31 - L'activation "primaire": Activation et sensibilisation des nocicepteurs
Ces substances inflammatoires "algogènes" agissent de différentes façons, elles peuvent
- produire une stimulation directe des nocicepteurs, c'est-à-dire une "activation" des nocicepteurs qui correspond en fait à produire le cycle complet de dépolarisation jusqu'à l'atteinte du seuil d'activation pour créer des influx nocicepteurs,
ou- sensibiliser les nocicepteurs, i.e. provoquer un abaissement du seuil d'activation des nocicepteurs ce qui vient ainsi faciliter leur activation à la suite d'un stimulus quelconque. Un plus faible stimulus est alors nécessaire pour franchir le seuil de potentiel transmembranaire nécessaire pour déclencher un influx douloureux et l'effet des différentes substances "algogènes" (K+, bradykinine, sérotonine, histamine, acétylcholine) se trouve ainsi grandement facilité.
Les prostaglandines et la substance P
- n'entraînent pas directement d'activation des nocicepteurs i.e. elles ne peuvent à elles seules provoquer la création d'influx nociceptifs,
- elles ont cependant pour effet de sensibiliser les nocicepteurs à toute stimulation douloureuse et de faciliter ainsi l'activation des nocicepteurs sensibilisés.
Les autres substances "algogènes" (K+, bradykinine, sérotonine, histamine, acétylcholine), pour leur part, "activent" directement les nocicepteurs.
Sensibilisation et activation sont donc deux phénomènes complémentaires qui prennent place au niveau des nocicepteurs dans les régions où les stimuli douloureux ont lieu.
32 - L'activation "secondaire"
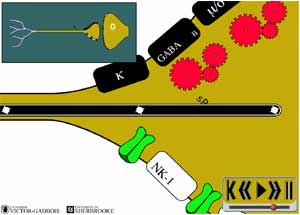
La présence de substances inflammatoires "algogènes" de plus en plus nombreuses au pourtour des nocicepteurs permet "d'activer" de plus en plus facilement les nocicepteurs, ce qui accentue encore plus le relâchement antidromique de substance P à partir des terminaisons nerveuses des fibres nociceptives.
La substance P concourt à plusieurs effets pour accentuer son action "algogène", elle agit sur 4 structures:
-
les capillaires locaux
-
elle augmente de façon considérable la perméabilité vasculaire, ce qui entraîne un oedème local et facilite encore plus l'accumulation de bradykinine en provenance des capillaires dilatés i.e. d'origine vasculaire
-
elle augmente de façon considérable la perméabilité vasculaire, ce qui entraîne un oedème local et facilite encore plus l'accumulation de bradykinine en provenance des capillaires dilatés i.e. d'origine vasculaire
-
les plaquettes
-
elle entraîne le largage de sérotonine à partir des plaquettes
-
elle entraîne le largage de sérotonine à partir des plaquettes
-
les mastocytes
- elle entraîne le largage d'histamine à partir des mastocytes
-
les terminaisons axonales elles-mêmes
- elle augmente de façon considérable l'oedème axonal.
L'augmentation de la perméabilité capillaire augmente la diffusion des substances algogènes d'origine vasculaire qui s'ajoute alors aux substances algogènes déjà produites localement par l'activité inflammatoire focale. Plus ces différentes substances s'accumulent, plus l'oedème se propage, plus le jeu de la sensibilisation et de l'activation des nocicepteurs s'étend en surface et plus la "zone douloureuse" s'agrandit. On réfère à ce phénomène d'élargissement de la zone douloureuse en terme "d'activation secondaire".
Le phénomène du cercle vicieux trouve alors sa véritable manière d'être. Plus la sensibilisation augmente, plus le nombre de nocicepteurs activés s'accentue, plus le nombre de nocicepteurs activés s'accentue, plus il y a de substance P libérée, plus il y a de substance P libérée et plus la concentration des nombreuses substances algogènes augmente, plus la concentration des nombreuses substances algogènes augmente, plus la sensibilisation des nocicepteurs augmente, plus la sensibilisation des nocicepteurs augmente, plus le nombre d'activation ... et le cercle vicieux se propage.
Plus le cercle vicieux se propage, plus le nombre d'influx nociceptif augmente; plus le nombre d'influx nociceptif augmente, plus le réseau nociceptif est sollicité; plus le réseau nociceptif est sollicité, plus le système de relais ou de transmission des influx nociceptifs est occupé à son tour. Plus le cercle vicieux se propage, plus la zone de douleur s'agrandit. Cette zone peut parfois prendre des proportions étonnantes.
33 - Le système "sympathique" ...qu'il ne fallait pas oublier!
Il ne faut surtout pas oublier, à travers toute cette cascade de réactions biochimiques, la présence et l'implication du système nerveux autonome sympathique (SNAS) (Voir: LA DOULEUR NOCICEPTIVE VISCERALE: SON PARCOURS DANS LE CIRCUIT NERVEUX AUTONOME). Le SNAS est intensément présent par ses terminaisons nerveuses en grand nombre au pourtour des vaisseaux sanguins et des nocicepteurs et les terminaisons du SNAS libèrent de la norépinéphrine (NE).
L'accumulation des substances algogènes dans l'environnement des terminaisons nerveuses du SNAS a pour effet d'activer ces mêmes terminaisons à libérer la norépinéphrine contenues dans ses terminaisons.
Par ailleurs, les influx nociceptifs alors créés par les stimuli douloureux et par les substances algonènes "sensibilisatrices et activatrices", activent, à l'étage médullaire où ils font leur entrée, des interneurones qui sont connectés avec les fibres préganglionnaires du SNAS. Le résultat est alors l'équivalent d'une activation par le centre de contrôle hypothalamique, les fibres préganglionnaires sont alors activées par les fibres nociceptives; elles deviennent donc sous double contrôle, hypothalamique et nociceptif. Les fibres préganglionnaires une fois activée par les interneurones font relais avec les fibres postganglionnaires qui sont connectées par leurs terminaisons avec les vaisseaux sanguins et les nocicepteurs. Encore plus de norépinéphrine contenues dans ces terminaisons est libérée.
Les terminaisons nerveuses du SNAS se trouvent ainsi "doublement" activées avec comme conséquence que de la norépinéphrine (NE) se retrouve en grande abondance au pourtour des capillaires, des nocicepteurs tissulaires et des nocicepteurs capillaires car il existe des nocicepteurs au niveau des vaisseaux sanguins (Voir: LES NOCICEPTEURS: LEURS LOCALISATIONS).
Cet important déversement de NE concourt à activer encore plus les nocicepteurs et à activer encore plus de nocicepteurs et donc à provoquer encore plus de douleurs. Sans compter qu'un effet vasoconstricteur, au début subtil, s'exerce déjà avec les conséquences ultérieures possibles de douleurs régionales complexes avec participation du SNAS.
Cette augmentation de catécholamines (NE) a aussi pour effet d'augmenter encore plus la sensibilité des nocicepteurs aux stimulations douloureuses et aux substances chimiques algogènes présentes. Le phénomène de "sensibilisation" connait ainsi un étrange effet d'amplification pour ne pas dire d'autoamplification et ces effets d'amplification dépendent donc de multiples facteurs agissant en synergie.
34 - L'impressionnante cascade de relais dans la transmission de l'influx douloureux
A la suite d'une stimulation douloureuse, un courant électrique "nociceptif" naît ainsi de l'effet combiné de la sensibilisation et de l'activation des nocicepteurs, cela dans un environnement où se joue un processus inflammatoire fort complexe. Ce courant électrique, porteur d'influx nociceptifs, se propage dans les fibres du réseau nociceptif, les fibres nociceptives.
A chaque fois que naissent des influx nociceptifs, et cela peu importe d'où elles originent, s'ensuit une cascade impressionnante de relais dans la transmission des signaux douloureux avant qu'ils n'aboutissent finalement au cerveau où ils seront identifiés comme stimuli douloureux.
Qu'en est-il donc de cette cascade impressionnante de relais dans la transmission des signaux douloureux mieux désignés par le vocable "afférences nociceptives"? Cette cascade est relativement complexe, mais son explicitation ouvre à une meilleure compréhension
35 - Le système de transport des influx nociceptifs: les fibres nerveuses ou neurones
Il existe dans le réseau nerveux, différents types de fibres avec différentes fonctions. Ces fibres sont des cellules nerveuses dont la caractéristique anatomique est de s'étendre sous la forme de "fins prolongements filamenteux" au lieu d'être de forme ronde comme une bonne majorité de cellules des tissus autres que le tissu nerveux. La cellule nerveuse s'appelle un neurone.
Le neurone est l'unité anatomique et fonctionnelle du système nerveux. Il est entouré d'une membrane cellulaire appelé membrane neuronale. L'influx électrique observé dans un neurone est en fait véhiculé au niveau de la membrane neuronale.
Il existe, au niveau des neurones nociceptifs, deux grandes divisions anatomiques:
- les neurones périphériques, qui partent des différentes structures où existent des nocicepteurs et qui transportent les influx douloureux jusqu'à la moelle
et
- les neurones centraux, qui transportent les influx douloureux à l'intérieur de la moelle et du cerveau jusqu'à leur point de réception et "d'interprétation".
Les neurones nociceptifs périphériques diffèrent des neurones nociceptifs centraux à certains égards.
36 - Le système de transport des influx nociceptifs: les neurones centraux et périphériques
Les neurones nociceptifs centraux sont formés:
- d'un corps cellulaire contenant le noyau cellulaire et qui se trouve au début de la fibre afférente,
- de multiples arborisations toutes très courtes disposées au pourtour du corps cellulaire (les dendrites),
- d'un seul long prolongement cylindrique (l'axone) de longueur variable selon le cas à l'autre extrémité du corps cellulaire i.e. à l'extrémité plus centrale. A partir de l'unique axone originant du corps cellulaire, ce long prolongement peut se terminer en fibre unique au moment de sa connexion avec une structure spécifique mais il peut aussi se terminer à sa portion la plus distale en un certain nombre de fins prolongements axonaux "filamenteux" de longueur variable selon les structures à rejoindre. Ces fins prolongements peuvent prendre l'allure d'embranchements multiples lorsqu'ils ont comme fonction d'assurer les nombreuses connexions multiétagées comme ce que l'on observe dans le cas des réseaux ascendants polysynaptiques (pex. paléospinothalamique).
Les neurones nociceptifs périphériques sont formés pour leur part:
- d'un corps cellulaire contenant le noyau cellulaire qui se trouve presque à la toute fin de la fibre afférente. de la fibre afférente. L'ensemble des corps cellulaires forme le renflement observable dans la racine postérieure au niveau du trou de conjugaison, ce renflement porte le nom de "ganglion spinal". A partir du corps cellulaire, le neurone nociceptif périphérique se divise rapidement en deux directions opposées: un prolongement vers la moelle et un prolongement vers la périphérie,
- d'un prolongement axonal vers la moelle et qui se rend jusqu'à la corne postérieure où il se termine. Ce prolongement forme en fait la racine à la hauteur du trou de conjugaison. Par la suite, il se termine en plusieurs arborisations qui vont faire connexions (synapse) sur les neurones centraux,
- d'un prolongement axonal vers la périphérie i.e. vers la structure innervée. Ce prolongement une fois arrivé dans la structure périphérique innervée, se ramifie à son tour habituellement en plusieurs "prolongements filamenteux". Ces fins prolongements axonaux "filamenteux" prennent l'allure d'embranchements multiples qui vont former tous ensemble finalement un nocicepteur.
37 - Les fibre nerveuses ou neurones: les différentes espèces anatomiques
Chaque fibre nerveuse peut être identifiée par trois paramètres:
- la taille, i.e. le diamètre
- la vitesse de conduction
et- la présence ou non d'un recouvrement de myéline et l'importance de ce recouvrement.
Six types de fibres sont ainsi décrites:
- A alpha (A
) - (motrices et sensorielles), aussi appelées Ia et Ib lorsqu'elles originent de structures musculaires ou articulaires, elles sont les plus grosses, les plus rapides et sont pourvues d'un abondant recouvrement de myéline. Elles sont connectées à des terminaisons spécialisées: fuseaux musculaires (muscle spindles), organes tendineux de Golgi (Golgi tendon organ), récepteurs spécialisés dans les tendons, les ligaments et les articulations. Ces terminaisons offrent les informations de nature kinesthésique sur: le degré d'étirement musculaire, l'angle de positionnement d'une articulation, le mouvement et la rapidité de mouvement d'une articulation.
- A bêta (A
) - (motrices et sensorielles), aussi appelées II lorsqu'elles originent de structures musculaires ou articulaires, elles sont assez grosses, passablement rapides et sont pourvues d'un recouvrement de myéline un peu moindre que les A alpha. Elles sont connectées à des terminaisons spécialisées qui sont encapsulées: corpuscules de Pacini (Pacinian corpuscles) - (vibration), corpuscules de Meissner (Meissner's corpuscles) - (toucher superficiel complexe), corpuscules de Ruffini et disques de Merkel. Ces terminaisons offrent les informations sur la stimulation cutanée complexe: les stimulations cutanées vibratiles (sens de la vibration), la discrimination tactile (discrimination deux points), la discrimination tactile complexe discriminative (par exemple identifier une pièce de monnaie dans la main), le sens de la position, le sens de vibration, le degré de pression subi par la surface cutanée.
- A gamma (A
) - (motrices seulement) elles sont un peu moins grosses, un peu moins rapides et pourvues d'un recouvrement de myéline un peu moins abondant que les A bêta.
- A delta (A
) - (sensorielles seulement), aussi appelées groupe III lorsqu'elles originent de structures musculaires ou articulaires, elles sont d'un diamètre plus petit que les autres A. Elles ne sont recouvertes que d'une fine couche de myéline et sont donc plus lentes que les trois autres A. Elles sont connectées à des terminaisons libres i.e. sans structures particulières en comparaison des terminaisons des fibres A alpha et A bêta. Les terminaisons libres connectées aux fibres A delta offrent les informations sur: le toucher léger superficiel, la stimulation thermique froide non douloureuse (terminaisons libres thermosensibles i.e. à faible seuil d'activation) et sur la douleur aiguë rapide de type "piqûre" (terminaisons libres nociceptives répondant à des stimulations à bas seuil d'activation mais capable de répondre à des seuils plus élevés: thermiques, mécaniques, chimiques). Elles sont aussi connectées à des terminaisons libres nociceptives ne répondant qu'aux stimulations à haut seuil d'activation [récepteurs polymodaux]: thermiques, mécaniques, chimiques). En fait la majorité des A delta est connecté à des récepteurs polymodaux.
- B - (motrices seulement) elles sont d'un diamètre encore un peu plus petit que celui de la A delta, elles sont recouvertes d'une plus fine couche de myéline que toutes les A et sont donc plus lentes que les A.
et
- C - (motrice et sensorielle) elles sont les plus petites de toutes les fibres nerveuses, elles sont dépourvues de tout recouvrement de myéline et sont donc très lentes de conduction, les plus lentes de toutes les fibres en fait. Elles sont appelées groupe IV lorsqu'elles originent de structures musculaires ou articulaires. Les fibres C dominent très largement comme population. Elles représentent en fait la très large majorité des afférences cutanées, entre 60-90 % de toutes les afférences cutanées et représentent de plus la presque totalité de toutes les afférences viscérales. Elles sont connectées à des terminaisons libres i.e. sans structures particulières en tout point identiques à celles des fibres A delta. Les terminaisons libres connectées aux fibres C offrent les informations sur: la stimulation thermique chaude non douloureuse (terminaisons libres thermosensibles i.e. à faible seuil d'activation) et sur la douleur aiguë "tardive ... de quelques secondes après l'information des A delta" de type "brulûre"(terminaisons libres nociceptives ne répondant qu'aux stimulations à haut seuil d'activation [récepteurs polymodaux]: thermiques, mécaniques, chimiques). L'immense majorité des fibres C est connectée à des récepteurs polymodaux.
Les axones des fibres A alpha, A bêta, A gamma et A delta du système nerveux central sont enveloppées d'une gaine de myéline qui est formée par une des cellules du SNC, les oligodendrocytes. Pour leur part, les axones des fibres A alpha, A bêta, A gamma et A delta et B du système nerveux périphérique sont enveloppées d'une gaine de myéline qui est formée par les cellules de Schwann, équivalent périphérique des oligodendrocytes centraux.
38 - Les fibres nerveuses "nociceptives": les fibres C et A Delta et leur fonction
Quand les nocicepteurs ont été activés, les influx électriques sont alors transportés vers le cerveau par les fins prolongements "filamenteux" axonaux, les fibres nociceptives. Le réseau nociceptif est constitué principalement de deux types de fibres nerveuses:
-
les fibres A delta
Ces fibres sont d'un diamètre un peu plus grand que les fibres C, elles sont recouvertes d'une mince couche de myéline. En partie en raison de l'isolant myélinisé, elles conduisent les influx plus rapidement ( 12 - 30 m/s) que les fibres C. Les fibres A delta originent pour la plupart des différents nocicepteurs autres que polymodaux.et
-
les fibres C
Ces fibres sont extrêmement fines et de conduction lente (environ 1 m/s), elles ne possèdent pas "d'isolant" de myéline à leur pourtour. Elles ne sont donc pas myélinisées. La plupart des fibres C originent des récepteurs polymodaux.
-
-
La douleur transportée par les fibres C est susceptible de devenir rapidement "intolérable", elle est diffuse et imprécise dans sa localisation et ressentie comme une brulûre ou un élancement.
-
La différence dans la vitesse de conduction explique pour une bonne part les deux étapes séquentielles qu'il nous est possible d'observer lorsque nous éprouvons de la douleur à la suite d'un stimulus douloureux relativement intense.
-
La première douleur: ainsi, par exemple, lorsqu'on se fait une incision "accidentelle" avec un objet tranchant, lorsqu'on met le pied sur une aiguille ou un clou, lorsqu'on se frappe un doigt avec un marteau on ressent une douleur "immédiate". Le temps de perception de cette première doulour est estimé, en laboratoire, à environ 200 millisecondes. Cette première douleur est le plus souvent définie comme une piqûre. Elle est bien localisée, est apparue extrêmement rapidement après le stimulus. Cette douleur aiguë provient du réseau nociceptif des fibres A delta. Elle a servi à ce qu'elle est censée servir: nous aviser par un signal non équivoque d'une agression qui pourrait même devenir plus importante. Des réflexes vifs se sont exercés pour en éliminer la cause ... si possible et pour en réduire les conséquences. Voilà l'expression du circuit nociceptif dans sa plus simple expression.
- La deuxième douleur: quelques secondes plus tard, environ 2 à 3 secondes, la douleur transportée par les fibres C, la deuxième douleur (la véritable, la tenace!) apparaît , celle-ci est beaucoup plus intense et incommodante et elle devient rapidement plus diffuse. Cette deuxième douleur est souvent ressentie comme une sensation de brûlure et/ou d'un élancement, elle est ressentie sur une surface beaucoup plus étendue que la première et il devient rapidement difficile de différencier ou de localiser l'endroit précis du traumatisme dans la zone élargie et diffuse où la douleur est ressentie (les informations proprioceptives que les fibres A delta fournissaient sont perdues parmi la dominance d'influx conduites par les fibres C "non proprioceptives"). Cette deuxième douleur nous fait "regretter" le traumatisme subi pendant souvent plusieurs jours! C'est ici que l'environnement inflammatoire des substances algogènes exerce tous ses méfaits.
Les fibres A delta véhiculent les influx nociceptifs en provenance des nocicepteurs:
- mécanorécepteurs
- thermorécepteurs
-
mécanothermiques.
Elles sont donc "branchées" avec ces différents récepteurs.
Les fibres C véhiculent les influx nociceptifs en provenance des nocicepteurs:
- mécanothermiques
-
récepteurs polymodaux.
Elles sont donc "branchées" avec ces différents récepteurs.
Les quatre autres types de fibres, les fibres
- A alpha
- A bêta
- A gamma
- B
n'ont pas comme fonction de transporter des influx nociceptifs. Les A alpha et A bêta transportent cependant des informations sensorielles (tactiles et proprioceptives
39 - Le système de transport des influx nociceptifs: l'architecture périphérique
La première série d'axones, à partir des nocicepteurs, s'appellent les axones périphériques. Ces axones périphériques se regroupent pour devenir des nerfs, qui, se regroupant, deviennent des plexus. Sur leur trajet afférent, ces fibres, toujours en périphérie, se regroupent ensuite pour devenir des racines. C'est par les racines postérieures finalement que les influx nociceptifs font "classiquement" leur entrée dans la moelle. Alors que la majorité des fibres nociceptives pénètrent dans la moelle par la racine postérieure pour aller terminer immédiatement à leur entrée i.e. en ipsilatéral, un certain nombre de fibres nociceptives C font exception et font leur entrée par les racines antérieures pour se diriger elles aussi dans la corne postérieure ipsilatérale.
A l'intérieur des nerfs, des plexus et de la partie "périphérique" des racines i.e. avant d'entrer par les trous de conjugaison, les fibres nociceptives tout comme les autres fibres sensitives n'ont pas de dispositions spécifiques ni de dispositions hiérarchiques selon leur diamètre, elles sont donc dispersées autant au centre qu'en périphérie. Il en sera autrement une fois entrées dans les trous de conjugaison.
40 - Le système de transport des influx nociceptifs: l'architecture hiérarchique des racines portérieure
Lors du transit par les racines postérieurs, les fibres nociceptives de même que les autres fibres sensitives jusqu'alors étalées et entre-mêlées dans les faisceaux nerveux périphériques avec les fibres motrices sans aucune disposition particulière, commencent à se disposer hiérarchiquement selon leur diamètre. Cette redispostion hiérarchique débute au niveau du trou de conjugaison i.e. à partir du moment où les racines sont recouvertes par la première couche méningée, la pie-mère, et cette disposition se maintient dans la zone d'entrée de la moelle et ce jusque dans la corne postérieure.
- Les plus grosses fibres, les fibres A alpha et A bêta dédiées au transport de la proprioception consciente i.e. la discrimination tactile (discrimination deux points), le sens de la position, le sens de vibration qui se fait dans les cordons postérieurs (faisceaux cuneatus et gracilis) se disposent dans la portion la plus postérieure ou dorsale de la racine. Elles peuvent ainsi se rendre, au niveau de la corne postérieure, vers la portion la plus médiane de celle-ci.
-
Les fibres de très petit diamètre, les fibres nociceptives C, se disposent dans la portion antérieure de la racine. Elles peuvent ainsi entrer immédiatement dans la portion la plus latérale de la moelle.
-
Les fibres de faible diamètre, A delta, en prédominance nociceptives, se disposent dans la portion moyenne de la racine, entre les fibres A alpha - A bêta et C. Elles peuvent ainsi se rendre, au niveau de la corne postérieure, vers la portion la plus intermédiaire de la corne postérieure, entre la zone de distribution des fibres A alpha - A bêta et C.
Même si elles n'ont pas de contribution à la nociception, les fibres A alpha et A bêta (proprioception consciente i.e. la discrimination tactile (discrimination deux points), le sens de la position, le sens de vibration), après leur entrée dans la moelle se divisent pour émettre deux axones:
-
un premier axone qui compose les cordons postérieurs et qui acheminent alors l'information discriminative et proprioceptive vers les centres supérieurs (c'est leur fonction première)
et
- un deuxième axone qui est en fait une collatérale dédié vers la corne postérieure. Cette collatérale vers la corne postérieure apporte ainsi la contribution "modulatrice" des grosses fibres A alpha et A bêta dont il sera discutée plus loin (Voir: L'EFFET "PORTILLON" (GATE CONTROL) SELON MELZACK ET WALL ET UNE PLUS NOUVELLE THEORIE: LE CONTROLE INHIBITEUR DIFFUS INDUIT PAR LA NOCICEPTION (CIDN)).
41 - Les fibres sensitives nociceptives et autres: le positionnement du corps cellulaire
Le corps cellulaire de toutes les fibres sensitives de C1 à S5 se retrouve dans le ganglion dorsal de la racine postérieure. Le ganglion dorsal est le gonflement anatomique présent au niveau de la racine postérieure à la hauteur du trou de conjugaison. Dans la perspective afférente de la nociception, la racine périphérique se divise en racine antérieure et en racine postérieure immédiatement avant son entrée par le trou de conjugaison et le ganglion dorsal survient immédiatement après cette division.
Le corps cellulaire de toutes les fibres nociceptives "crâniennes" et même plus de toutes les fibres sensitives "crâniennes" en provenance de
- la face (peau, structures osseuses, articulations temporo-mandibulaires),
- la cornée
- les sinus
- les muqueuses nasales, sinusales et buccales,
- la partie antérieure de la langue,
- la dentition,
se retrouve dans le ganglion du trijumeau aussi appelé ganglion semi-lunaire ou de Gasser (Gasserian), situé dans l'espace intra-crânien à la base du crâne sous le lobe temporal dans une citerne dure-mérienne elle-même prenant place dans une empreinte de l'os temporal: le cavum de MECKEL. Dans la portion extra-crânienne du trijumeau, les afférences fortement étalées finissent par former trois branches (ophtalmique (I), maxillaire (II) et mandibulaire (III)) qui pénètrent dans l'espace intracrânien à travers la stucture osseuse faciale antérieure par trois foramen différents. Ces foramen sont en fait les équivalents des trous de conjugaison pour les espaces intervertébraux:
-
la branche ophtalmique (V-1) uniquement sensorielle pénètre dans l'espace intra-crânien par la fissure orbitaire supérieure et qui se réunissent dans la paroi latérale du sinus caverneux,
-
la branche maxillaire (V-2) elle aussi uniquement sensorielle pénètre dans l'espace intra-crânien par le foramen rotondum à la base du crâne,
- la branche mandibulaire (V-3) sensorielle et motrice (masticateurs, tensor tympani et quelques autres) pénètre dans l'espace intra-crânien par le foramen ovale.
42 - Le système de transport des influx nociceptifs périphériques: le terminus périphérique médullaire des influx C1 à S5
Les fibres nociceptives en provenance de la racine postérieure pénètrent dans la moelle au niveau de la région postérieure et la zone où se fait cette entrée s'appelle la corne postérieure. La portion de la corne postérieure où se terminent les fibres nociceptives s'appelle la substance grise.
43 - Le système de transport des influx nociceptifs périphériques: le terminus périphérique tronculaire des influx craniens
Au niveau du tronc cérébral, la substance grise de la corne postérieure possède son équivalent dans le noyau spinal du trijumeau Ce noyau reçoit les afférences nociceptives des différentes structures crâniennes. Après avoir fait leur entrée dans le tronc cérébral par le nerf V au niveau de la protubérance, les fibres nociceptives périphériques forment un long faisceau descendant dans le tronc cérébral, c'est le faisceau spinal du trijumeau. Immédiatement accolé à ce faisceau descendant, se trouve, un peu plus en médial, le noyau spinal du trijumeau où les afférences nociceptives du V se termineront.
Les afférences autres que nociceptives en provenance des structures crâniennes arrivent au niveau du noyau sensoriel principal du trijumeau. Les événements relativement complexes survenant au niveau de la corne postérieure s'appliquent tout autant au noyau spinal du trijumeau.
44 - Le système de transport des influx nociceptifs périphériques: le terminus périphérique et ses variantes
Autant au niveau de la corne postérieure qu'au niveau du noyau spinal du trijumeau, les fibres nociceptives se terminent dès qu'elles ont fait leur entrée dans la substance grise de la corne postérieure, elles se terminent donc du même côté où elles ont pénétré, c'est donc dire que la terminaison des fibres nociceptives est ipsilatérale.
Cependant, un certain nombre de fibres nociceptives vont se rendre directement dans la substance grise de la corne postérieure controlatérale en passant derrière le canal central médullaire.
Par ailleurs, comme rapporté un peu plus antérieurement, alors que la majorité des fibres nociceptives pénètrent dans la moelle par la racine postérieure pour aller terminer immédiatement à leur entrée i.e. en ipsilatéral, un certain nombre de fibres nociceptives C font exception et font leur entrée par les racines antérieures pour se diriger elles aussi dans la corne postérieure ipsilatérale.
Il convient ici d'insister sur deux particularités en ce qui concerne la terminaison des fibres nociceptives au niveau de la corne postérieure:
-
un certain nombre de fibres nociceptives font leur entrée par les racines antérieures, parmi celles-ci :
-
un certain nombre de fibres nociceptives vont se rendre dans la corne postérieure du même côté (ipsilatéral)
-
un certain nombre de fibres nociceptives vont se rendre dans la corne postérieure du même côté (ipsilatéral)
- un autre groupe de fibres nociceptives qui ont fait leur entrée par la racine postérieure vont se rendre directement dans la substance grise de la corne postérieure controlatérale.
-
-
Ces particularités permettent d'expliquer "en partie" pourquoi la section d'une racine postérieure (rhizotomie) peut apporter un soulagement partiel des douleurs sans permettre d'éliminer complètement les douleurs. Elles lèvent aussi le voile sur les incongruences dans les résultats lors de certaines autres interventions neurochirurgicales à visée analgésique dont il sera fait mention dans le Manuel V de cette série portant sur les approches non-médicamenteuses.
45 - Le système de transport des influx nociceptifs périphériques: l'éparpillement multi-étage
Après avoir ainsi fait leur entrée dans la moelle, les fibres C et A delta se divise en plusieurs branches qui prennent alors trois directions:
-
certaines demeurent au même étage que leur niveau d'entrée, ce sont les branches segmentaires
-
d'autres se dirigent vers les étages supérieurs ce sont les branches montantes et on parle alors de direction "cephalad"
et
-
d'autres se dirigent vers les étages inférieurs, ce sont les branches descendantes et on parle alors de direction "caudad".
Les fibres qui prennent ainsi les directions "cephalad" et "caudad" voyagent dans un réseau "ascenseur" situé à l'entrée immédiate de la moelle, le faisceau de Lissauer.
Ainsi, tout s'organise pour que l'information nociceptive puisse rapidement aviser plusieurs étages médullaires d'un problème en périphérie.
46 - L'éparpillement multi-étage: la différence entre les afférences somatiques et viscérales
La majorité des afférences nociceptives somatiques
- limitent habituellement leurs incursions à 1 ou 2 étages plus haut et plus bas que leur point d'entrée pour faire un éparpillement total sur 3 à 4 étages
alors que les afférences nociceptives viscérales
- ont tendance à s'éparpiller sur 2 à 3 étages autant en cephalad qu'en caudad, pour faire un éparpillement total sur 5 à 6 étages au total.
Les conséquences de cet éparpillement se concrétiseront quand viendra le temps d'expliciter les douleurs "référées", particulièrement les douleurs référées viscérales.
Cet éparpillement se manifeste sous divers aspects comme il sera discuté ultérieurement. Il aide à mieux comprendre:
- la douleur "référée"
- la limite des bénéfices analgésiques par les interventions reposant sur les blocs radiculaires et les sections radiculaires.
47 - Le terminus périphérique et le premier relais central: la corne postérieure et sa constitution en couches
La corne postérieure où se terminent les fibres nociceptives C et A delta périphériques, se divise en de nombreuses couches (laminae), plus d'une dizaine. Ces couches sont formées principalement:
-
des corps cellulaires des faisceaux nociceptifs "centraux" ascendants ou afférents
mais aussi -
de cellules intermédiaires remplissant différentes fonctions
et - de courts neurones (interneurones) remplissant eux aussi différentes fonctions dont celles de modulation.
Cet arrangement en couche est fait de façon très ordonnée. Chacune des dix couches contient une représentation "cartographique" de la surface du corps. Cette configuration "cartographique" au niveau de la corne postérieure est l'équivalent de l'homonculus cortical que l'on retrouve au niveau des cortex moteurs et sensitifs. On y réfère sous le nom de "cartographie somatotopique".
Les couches (laminae) I, II, III, IV, V, VI, et VII sont impliquées dans le transfert des influx nociceptifs mais mais les couches I à V sont les couches les plus particulièrement concernées. On réfère souvent aux quatre couches I-II-III-IV dans une nomenclature qui se divise en trois portions:
- la zone marginale (de Waldeyer) qui est l'équivalent de la couche I
-
la substance gélatineuse (substancia gelatinosa) qui est l'équivalent de la couche II
et - le nucleus proprius qui comprend les couches III et IV.
La couche V est aussi très concernée par les transferts nociceptifs, elle est le siège des neurones convergents (Wide-Dynamic-Range) qui recoivent tous les types d'afférences et de toutes les structures (peau, muscles/os/articulations, viscères).
Les fibres A delta, qu'elles soient demeurées au même étage ou qu'elles aient cheminé dans le faisceau de Lissauer (voir: LE SYSTEME DE TRANSPORT DES INFLUX NOCICEPTIFS PERIPHERIQUES: L'EPARPILLEMENT MULTI-ETAGE), se terminent
- principalement dans la couche I (ZONE MARGINALE)
-
secondairement dans la couche V
et - aussi quelque peu dans la couche II latérale.
Les fibres C, qu'elles soient demeurées au même étage ou qu'elles aient cheminé dans le faisceau de Lissauer (voir: LE SYSTEME DE TRANSPORT DES INFLUX NOCICEPTIFS PERIPHERIQUES: L'EPARPILLEMENT MULTI-ETAGE), se terminent
-
de façon nettement préférentielle dans la couche II (SUBSTANCE GÉLATINEUSE)
et - aussi quelque peu dans les couches I et V.
Les afférences sensitives (non-nociceptives) des grosses fibres A alpha et A bêta se divisent en deux contingents, un premier qui monte dans les cordons postérieurs, un second qui se termine
-
de façon nettement préférentielle dans les couches III, IV et V
et -
aussi quelque peu dans les couches II et VI.
C'est donc dire que la couche V reçoit des afférences de tous les types de fibres sensitives: A alpha, A bêta, A delta et C. On verra plus loin que la couche V reçoit des afférences de toutes les structures anatomiques, soient des afférences cutanées, musculo-squelettiques et viscérales. Voilà peut-être encore une portion des explications pour les douleurs référées!
Trois groupes de structures anatomiques fournissent des afférences à la corne postérieure, ce sont les groupes d'origine
- cutanée,
-
musculo-squelettique
et - viscérale.
Parmi ces trois groupes, chaque groupe d'afférences possède ses couches préférentielles. Ainsi, les afférences d'origine viscérale, musculo-squelettique et d'origine cutanée se comportent chacune différemment. Les afférences d'origine viscérale et musculo-squelettique n'envoient pas de projections dans les couches II, III et IV; c'est donc dire qu'elles sont absentes de la substance gélatineuse et du nucleus proprius.
Les afférences d'origine musculo-squelettique
- envoient leurs projections dans les couches I (marginale) et dans les couches V et VI
alors que
-
les afférences d'origine viscérale
- envoient leurs projections dans les couches I, V, VII et X. Bien plus, les afférences d'origine viscérale envoient souvent leurs projections de façon bilatérale.
-
et
les afférences d'origine cutanée
-
abondent dans les couches I et II et se retrouvent quelque peu dans la couche V.
En regard de la surface cutanée, chaque neurone nociceptif est connecté à une portion anatomique spécifique de la surface cutanée, cette portion s'appelle "le champ récepteur". Chaque champ récepteur constitue une toute petite portion d'un dermatome, un dermatome étant la surface cutanée dont l'innervation est associée de façon préférentielle à une racine particulière (ou nerf spinal). Chaque champ récepteur recouvre une partie d'un autre champ récepteur lui aussi nociceptif. Il existe ainsi une importante superposition de champs récepteurs pour toute surface donnée. Par ailleurs, à l'exemple des champs récepteurs nociceptifs, chaque type de perception sensorielle posséde ses propres champs récepteurs ce qui amène finalement un important chevauchement de différents champs récepteurs appartenant chacun à des afférences sensorielles différentes.
48 - Le terminus périphérique et le premier relais central: la corne postérieure, le bouton pré-synaptique et les espaces synaptiques
Les fibres nociceptives se terminent dans différentes couches de la corne postérieure comme mentionné précédemment. A leur point de terminaison, les fibres connaissent un léger renflement auquel on réfère comme étant le bouton pré-synaptique.
Par le bouton pré-synaptique, les fibres se connectent avec une fibre dite "centrale". La zone où se fait l'interconnexion "bout à bout" entre deux fibres nerveuses s'appelle une synapse. Une synapse est un espace réel entre les deux extrémités des fibres nerveuses qui s'interconnectent. Cet espace anatomique réel est borné par deux membranes neuronales, la membrane pré-synaptique, celle qui transmet l'influx et la membrane post-synaptique, celle qui reçoit l'influx.
C'est donc dire que la corne postérieure s'avère un lieu où se déroule un nombre incalculable d'interconnexions, non seulement elles s'y déroulent mais elles y sont aussi gérées. La corne postérieure, siège de millions d'interconnexions synaptiques, est un peu à l'image de la cour de triage la plus complexe qu'il pourrait être possible d'imaginer. Les millions d'axones "périphériques nociceptifs" contenus dans les racines échangent à ce niveau leur information avec les fibres centrales.
On verra dans le cas des douleurs qui se prolongent le moindrement que la gestion de ce réseau complexe d'échanges peut devenir difficile et même connaître une désorganisation déroutante ouvrant ainsi la voie à des douleurs intenses, étendues et difficile à maîtriser.
49 - La transmission d'un influx dans l'espace synaptique: le bouton pré-synaptique et la libération d'un neurotransmetteur
Lorsqu'un influx nociceptif ou autre arrive au niveau du bouton pré-synaptique, une cascade d'événements électrochimiques se produit:
-
l'arrivée de cet influx entraine un début de dépolarisation qui s'accentue jusqu'à déclencher l'ouverture de canaux sodiques (Na+) et calciques (Ca++) "VOLTAGE DÉPENDANTS" situés sur la membrane du bouton pré-synaptique,
-
l'ouverture de ces canaux amène le potentiel transmembranaire au niveau du seuil d'activation, d'autres canaux "voltage dépendants" s'ouvrent alors pour provoquer l'arrivée plus massive de (Ca++) à l'intérieur du bouton pré-synaptique. Cette arrivée plus massive est responsable du "soutien métabolique excitateur" intra-cellulaire. L'usine métabolique intracellulaire se met en branle,
-
de fait, ce soutien engendre la production et la libération de NTs nociceptifs ou "excitateurs" dans l'espace synaptique,
- les NT nociceptifs qui se retrouvent alors dans l'espace synaptique vont se fixer sur leurs récepteurs spécifiques au niveau de la membrane post-synaptique afin de recréer l'influx dans la fibre nociceptive centrale cette fois-ci.
La libération de NTs se fait en quantité "déterminée" à laquelle on donne le nom de "quantum". Ainsi, l'arrivée d'un train d'influx au niveau du bouton pré-synaptique libère un certain nombre de quanta, ces quanta entraînent dans le cas de NTs "excitateur" un certain degré de dépolarisation de la membrane post-synaptique. Plus le nombre de quanta augmente, plus il devient possible d'atteindre le seuil d'activation nécessaire pour déclencher les potentiels d'action générant, de ce fait, un nouveau train d'influx "nociceptifs" cette fois-ci dans la fibre centrale qui vient d'être activée. Et il en est ainsi, tout au long de l'ascension vers les régions supérieures où se feront les relais "nociceptifs".
C'est la quantité de (Ca++) migrant à l'intérieur du bouton pré-synaptique qui fait la régulation du nombre de quanta libérés. L'usage d'inhibiteurs calciques agissant spécifiquement sur le réseau nociceptif pourrait donc trouver une application co-analgésique à ce niveau, les bloqueurs calciques usuels n'ont pas d'effet à ce niveau et ne font donc pas partie de l'arsenal courant de co-analgésiques cependant le gabapentin et les médicaments de sa famille pourraient peut-être posséder une partie de cet effet.
On verra plus loin que l'effet des NTs pourra être autant "excitateur" i.e. activer l'activité métabolique à l'intérieur de la cellule que "inhibiteur" i.e. réduire cette même activité.
50 - La transmission d'un influx dans l'espace synaptique: la membrane synaptique et ses deux grandes familles de récepteurs
Les récepteurs "biochimiques" présents sur les membranes pré et post-synaptiques sont des récepteurs moléculaires complexes qui peuvent se retrouver en deux endroits:
-
directement à la surface des canaux ioniques
ou - directement à la surface de la membrane neuronale.
Lorsque les récepteurs moléculaires sont situés à la surface de canaux ioniques, leur activation entraîne un
- effet rapide immédiat qui peut être de deux ordres, une rapide dépolarisation ou une rapide hyperpolarisation.
Lorsque les récepteurs moléculaires sont situés à la surface de la membrane neuronale, leur activation nécessite
-
plus de temps avant d'entraîner leurs effets. Ils doivent en effet passer par un intermédiaire chimique, un second messager, habituellement un sous-type de protéine du groupe des protéines G. Le sous-type de protéine G concerné doit alors se rendre activer d'autres récepteurs cibles qui lui sont propres à l'intérieur de la cellule. On assiste alors à une cascade d'activation enzymatique intra-cellulaire, chaque nouvelle structure activée enclenchant d'autres processus métaboliques dont l'aboutissement final sera de produire enfin le ou les effets désiré(s).
Dans le cas du contrôle des canaux ioniques, la résultante finale sera d'ouvrir ou de fermer les canaux ioniques cibles mais cette fois-ci à partir d'un stimulus venant de l'intérieur. Encore ici, l'effet final pourrait être une dépolarisation ou une hyperpolarisation mais cet effet sera retardé en comparaison avec la stimulation directe des canaux ioniques à la surface extra-cellulaire.
L'augmentation ou la réduction de l'excitabilité membranaire est donc liée à une chaîne de processus métaboliques intra-cellulaires qui imposent un certain délai avant de se répercuter sur les canaux ioniques visés. Les canaux ioniques activés par les récepteurs membranaires sont donc impliqués plus tardivement en comparaison de ceux possédant des récepteurs immédiatement à leur surface.
Notes personnelles dans une perspective de soins palliatifs "oncologiques" Par : Brizard, André, MD
Notes personnelles dans une perspective de soins palliatifs "oncologiques" Par : Brizard, André, MD
51 - La transmission d'un influx dans l'espace synaptique: la membrane post-synaptique et les neurotransmetteurs "excitateurs"

Lorsqu'un NT "excitateur" se fixe sur un récepteur qui lui est spécifique au niveau de la membane post-synaptique, peu importe que ce récepteur soit situé directement à la surface des canaux ioniques ou de la membrane neuronale, il produit alors une ouverture des canaux "médiateurs dépendants":
-
les canaux sodiques (Na+)
et/ou - les canaux calciques (Ca++).
Il va sans dire que les canaux ioniques "voltage-dépendants", qu'ils soient sodiques ou calciques ne sont pas impliqués dans ce processus d'activation, leur sort a été décrit antérieurement. (Voir: LA TRANSMISSION D'UN INFLUX DANS L'ESPACE SYNAPTIQUE: LE BOUTON PRE-SYNAPTIQUE ET LA LIBERATION D'UN NEUROTRANSMETTEUR).
Les canaux sodiques (Na+) sont les grands responsables de la dépolarisation progressive menant finalement à l'induction d'un influx en permettant le transfuge d'ions (Na+) à travers la membrane cellulaire (Voir: LE PHENOMENE DE DEPOLARISATION "MEMBRANAIRE"). Le potentiel transmembranaire passe alors de - 70 mV à - 50 mV par exemple et ainsi de suite. Au fur et à mesure que d'autres NTs arrivent au niveau de leurs récepteurs spécifiques sur la membrane post-synaptique, d'autres canaux sodiques s'ouvrent et le phénomène de dépolarisation s'accentue de plus en plus. Il finit par atteindre "le" seuil de voltage transmembranaire nécessaire pour faire ouvrir l'autre type de canaux ioniques, les canaux "voltage dépendants". Alors survient la migration massive d'ions (Na+) et d'ions (Ca++) en intra-cellulaire. Cette migration massive permet de générer le potentiel d'action nécessaire au déclenchement d'un influx nociceptif, bien plus, d'un train d'influx dans la fibre centrale. La montée des influx vers les centres supérieurs est ainsi assurée.
Les canaux calciques (Ca++) sont responsables pour leur part du soutien métabolique "excitateur" intra-cellulaire en permettant l'entrée d'abord modérée et ensuite "massive" de (Ca++) à l'intérieur de la cellule nécessaire aux différents processus métaboliques menant à la production et à la libération de NTs à l'autre extrémité de la fibre centrale dans les centres supérieurs où la neurotransmission se poursuit jusqu'à l'arrivée de l'influx dans le cortex pariétal à titre d'exemple.
C'est de cette façon que les principaux NTs nociceptifs agissent (glutamate et substance P) en regard des canaux sodiques et calciques. Le glutamate agit de façon relativement plus complexe, il sera discuté avec les récepteurs NMDA (Voir: LES RECEPTEURS NMDA ET ... LES RECEPTEURS NON-NMDA: LEURS ROLES EN SITUATION D'HYPERACTIVITE PERIPHERIQUE).
Les canaux calciques (Ca++) sont responsables pour leur part du soutien métabolique "excitateur" intra-cellulaire en permettant l'entrée modérée et en certaines occasions "massive" de (Ca++) à l'intérieur de la cellule nécessaire aux différents processus métaboliques menant à la production et à la libération de NTs.
C'est de cette façon que les principaux NTs nociceptifs agissent (glutamate et substance P) en regard des canaux sodiques et calciques. Le glutamate agit de façon relativement plus complexe, il sera discuté avec les récepteurs NMDA (Voir: LES RECEPTEURS NMDA ET ... LES RECEPTEURS NON-NMDA: LEURS ROLES EN SITUATION D'HYPERACTIVITE PERIPHERIQUE).
52 - La transmission d'un influx dans l'espace synaptique: la membrane post-synaptique et les neurotransmetteurs "inhibiteurs"
Lorsqu'un NT "inhibiteur" se fixe sur un récepteur qui lui est spécifique, peu importe que ce récepteur soit situé directement à la surface des canaux ioniques ou de la membrane neuronale, il produit alors, de façon concomitante, une ouverture des canaux "médiateurs dépendants"
-
les canaux chloriques (Cl-)
et - les canaux potassiques (K+).
(Voir: LA TRANSMISSION D'UN INFLUX DANS L'ESPACE SYNAPTIQUE: LA MEMBRANE POST-SYNAPTIQUE ET SES DEUX GRANDES FAMILLES DE RECEPTEURS).
L'ouverture des canaux chloriques (Cl-) entraîne une migration des ions (Cl-) vers l'intérieur de la cellule, ce qui a pour effet d'accentuer la charge négative intracellulaire.
En même temps, l'ouverture des canaux potassiques (K+) permet au K+ de migrer vers l'extérieur ce qui vient encore accentuer encore plus la charge négative intracellulaire et donc l'hyperpolarisation. La contribution des canaux potassiques (K+) est plus importante que celle des canaux chloriques (Cl-). C'est particulièrement de cette façon que les opiacés agissent comme nous le verrons plus loin, i.e. en augmentant la migration vers le milieu neuronal des ions potassiques (K+).
On réfère à cette facilitation du passage d'un ion d'un milieu vers un autre comme à une conductance augmentée.
En présence d'un NT "inhibiteur", l'hyperpolarisation de la membrane post-synaptique sera "prolongée". Cette hyperpolarisation, qui est en fait une accentuation de la négativité intracellulaire, a pour effet d'empêcher la structure de réagir à un stimulus. Ainsi l'arrivée d'un influx nociceptif en provenance de la périphérie ou la présence d'un NT "excitateur" nociceptif ne seront plus en mesure de provoquer les effets qu'ils auraient dû provoquer.
53 - La transmission d'un influx dans l'espace synaptique: les neurotransmetteurs "inhibiteurs", l'hyperpolarisation et les effets sur le bouton pré-synaptique et le neurone central
Les membranes des boutons pré-synaptiques de même que les membranes des neurones centraux possèdent des récepteurs "biochimiques" sur lesquels les NTs "inhibiteurs" peuvent agir.
Au niveau de la membrane des boutons pré-synaptiques,
- l'hyperpolarisation aura comme conséquence de provoquer une certaine inhibition des canaux calciques "voltage dépendants" puisque l'arrivée d'un influx au niveau du bouton pré-synaptique ne permettra plus d'atteindre le voltage transmembranaire nécessaire à l'ouverture de ces mêmes canaux calciques. Ainsi, à titre d'exemple, le potentiel transmembranaire nécessaire à l'ouverture des canaux calciques pourrait dans un cas donné se situer autour de -30 mV pour un potentiel de repos de -70 mV, soit une différentielle de 40 mV. Ce potentiel n'atteindra que -45 mV avec l'arrivée de l'influx en provenance de la périphérie lorsque le potentiel transmembranaire de dépolarisation se trouve à -85 mV.
Ainsi, l'absence d'arrivée de Ca++ intracellulaire nécessaire à toute activation de la cascade biochimique empêchera la production et à la libération subséquente de neurotransmetteurs "nociceptifs" (glutamate, substance P et autres) à partir de la membrane pré-synaptique du bouton pré-synaptique même en présence d'influx nociceptifs. Beaucoup moins de NTs nociceptifs se retrouvent alors dans l'espace synaptique. Moins de NTs nociceptifs, moins de douleur.
Nous verrons plus tard que les opiacés agissent en partie de cette façon sur les boutons pré-synaptiques pour exercer leur effet analgésique.
Au niveau de la membrane des neurones centraux,
- l'hyperpolarisation aura pour effet d'empêcher la membrane post-synaptique du neurone central d'atteindre le voltage transmembranaire nécessaire au déclenchement d'un potentiel d'action. Ainsi, à titre d'exemple, le potentiel transmembranaire nécessaire au déclenchement d'un potentiel d'action qui pourrait se situer autour de +10 mV pour un potentiel de repos de -70 mV, soit une différentielle de 80 mV, n'atteindra que -5 mV lorsque le potentiel transmembranaire de départ se trouve à -85 mV.
Il ne semble pas que l'activation des récepteurs opioïdes (enképhalinergiques, dynorphinergiques) à ce niveau puisse provoquer, comme dans le cas des boutons pré-synaptiques, une hyperpolarisation suffisante pour provoquer une inhibition "valable" des canaux calciques "voltage dépendants". Cette ajout d'inhibition aurait pu avoir comme conséquence "heureuse" de réduire encore plus les influx nociceptifs ascendants mais tel n'est pas le cas.
C'est par l'un ou l'autre de ces deux mécanismes que les substances "inhibitrices" (enképhaline, dynorphine, norépinéphrine et GABA) exercent leur effet "analgésique". Il existe des récepteurs enképhalinergiques, dynorphinergiques, alpha2-adrénergiques et GABAergiques tant au niveau du bouton pré-synaptique que du neurone central des fibres nociceptives.
Par ailleurs, les récepteurs GABAergiques se retrouvent en beaucoup plus grand nombre sur les boutons pré-synaptiques de terminaisons motrices au niveau des jonctions neuro-musculaires que sur les boutons pré-synaptiques des fibres nociceptives c'est pourquoi le baclofen est beaucoup plus efficace pour réduire la spasticité que pour réduire la douleur même lorsqu'administré en épidural.
Dans l'ensemble, le nombre de récepteurs "inhibiteurs" prédomine nettement au niveau des boutons pré-synaptiques des fibres nociceptives en comparaison avec les neurones centraux. Ce qui fait qu'une bonne partie du blocage nociceptif se fait en pré-synaptique, environ 75% du blocage nociceptif se fait à ce niveau, il ne reste que 25% pour la contribution de la membrane post-synaptique du neurone central.
L'effet des neurotransmetteurs inhibiteurs semble donc ne reposer que sur l'hyperpolarisation résultant de l'ouverture des canaux potassiques et chloriques. Ces NTs "inhibiteurs" réussissent quand même, par cet effet unique, à exercer une large contribution "analgésique".
On verra quand il sera question des récepteurs NMDA que leur activation provoquera entre autre la production de NO (monoxyde d'azote) dans les neurones centraux. Le NO ainsi produit diffusera partout dans le corps cellulaire des neurones centraux, il diffusera aussi à l'extéreure des neurones centraux pour se rendre dans les boutons pré-synaptiques et dans les cellules gliales. Au niveau des boutons pré-synaptiques, un des effets du NO sera d'entrainer la fermeture des canaux potassiques responsables de l'hyperpolarisation observable suite à une stimulation des récepteurs opiacés. La fermeture des canaux potassiques empêchera ainsi l'hyperpolarisation de se produire et réduira en conséquence considérablement l'effet analgésique des opiacés.
54 - La corne postérieure: une "cour de triage" complexe
La schématisation du mode de communication entre deux neurones montre habituellement un neurone dont le bouton pré-synaptique fait son transfert d'influx avec un neurone central tout comme si la communication dans le réseau nerveaux se faisait toujours "de un à un". Il en est pourtant tout autrement. Chaque dendrite de chacun des neurones centraux nociceptifs peut être branché à une afférence nociceptive différente. Plusieurs afférences nociceptives arrivent donc en même temps sur un même neurone nociceptif central, ces afférences étant en provenance:
-
de divers nocicepteurs
- mécanorécepteurs
- thermorécepteurs
- récepteurs mécanothermiques
- récepteurs polymodaux.
Mais il y a pire encore puisque chaque fibre nociceptive centrale peut recevoir en même temps des afférences nociceptives en provenance:
| - de diverses structures anatomiques | |
| • | somatiques |
| • | viscérales |
| - de divers sites anatomiques | |
| • | dermatome |
| • | myotome |
| • | sclérotome |
Cette convergence d'arrivée entre des influx nociceptifs qui sont d'origines variées, de zones et de structures anatomiques diverses amène donc des interconnexions synaptiques de variétés multiples. Le phénomène des douleurs référées trouve probablement dans ces multi-convergences une partie de son explication (Voir: EPARPILLEMENT MULTI-ETAGE, MULTI-CONVERGENCE ET DOULEUR REFEREE).
La situation se trouve encore plus complexe puisque ces dendrites sont aussi soumis aux connexions synaptiques en provenances
- des faisceaux inhibiteurs descendants dont il sera fait mention un peu plus loin (Voir: LA CONTREPARTIE DES FAISCEAUX ASCENDANTS: LES FAISCEAUX DESCENDANTS INHIBITEURS)
- des fibres sensitives non-nociceptives qui elles sont branchées à de nombreux récepteurs "non-nociceptifs". (Voir: LES AUTRES INFORMATIONS SENSITIVES ET LEURS RECEPTEURS)
Ces deux derniers groupes d'influx font référence à l'effet "portillon" (Gate Control) proposé par Melzack et Wall au début des années soixante. L'effet "portillon" sera discuté ultérieurement dans le présent document. (Voir: L'EFFET "PORTILLON" (GATE CONTROL) SELON MELZACK ET WALL ET UNE PLUS NOUVELLE THEORIE: LE CONTROLE INHIBITEUR DIFFUS INDUIT PAR LA NOCICEPTION (CIDN))
55 - La transmission d'un influx dans l'espace synaptique: les neurotransmetteurs
Cette multi-convergence impose en même temps la nécessité d'assurer le relais de l'influx électrique dans les multiples connexions synaptiques. Ce transfert des influx électriques nociceptifs entre deux neurones se fait par l'intermédiaire de substances chimiques qu'on appelle des neurotransmetteurs (NTs). Il existe plusieurs substances chimiques jouant le rôle de neurotransmetteurs. La convergence qui se fait sur les dendrites des neurones nociceptifs centraux, à partir de sites et de structures multiples, impliquera plusieurs neurotransmetteurs différents afin de communiquer ces différentes informations.
Les principaux neurotransmetteurs "nociceptifs" identifiés jusqu'à maintenant, i.e. ceux qui transfèrent l'information "nociceptive" de la fibre périphérique à la fibre centrale, sont:
-
le glutamate
et - la substance P
mais il en existe plusieurs autres
- le peptide lié au gène de la calcitonie (Calcitonine Gene Related Peptide - CGRP)
- la somatostatine
- le polypeptide intestinal vaso-actif (Vaso-active Intestinal Peptide - VIP)
- et encore bien d'autres.
-
Un certain nombre de fibres nociceptives libèrent à la fois du glutamate et de la substance P qui coexistent au niveau de leur bouton pré-synaptique mais une bonne majorité des fibres nociceptives ne possèdent que le glutamate ou que la substance P comme neurotransmetteur nociceptif.
-
-
Le glutamate représente le plus important neurotransmetteur "excitateur" de tout le système nerveux central. Le GABA est pour sa part le plus important neurotransmetteur "dépresseur".
56 - La "cour de triage" complexe: le premier relais central avec ses différents circuits et sous-circuits de connexion
Le relais de l'influx électrique nociceptif entre deux neurones est assuré par l'intermédiaire des neurotransmetteurs (NTs). Cependant, les deuxièmes neurones nociceptifs ne sont souvent que de très courts neurones "centraux" qui font le pont avec les vrais neurones centraux qui sont ceux qui vont acheminer les influx nociceptifs vers les régions supérieures, c'est-à-dire le tronc cérébral et le cerveau.
Au niveau de la corne postérieure, les connexions synaptiques à partir des différentes provenances périphériques énumérées plus haut peuvent donc se faire:
-
DIRECTEMENT sur un neurone central
ou - INDIRECTEMENT c'est -à-dire par l'intermédiaire de petits neurones (2 types) avant d'atteindre le neurone central.
DIRECTEMENT sur un neurone central
Il existe, au niveau de la corne postérieure, trois types de neurones nociceptifs centraux vers lesquels le transfert d'influx nociceptifs se fait:
- les neurones spécifiquement nociceptifs (Nociceptive Specific - NS) aussi appelés "neurones marginaux larges" (Large Marginal Neurons (LMN). Les LMN/NS sont surtout situées dans la couche I, i.e. dans la zone marginale de la corne postérieure. Ils sont présents en faible nombre dans les couches II et III. Ils reçoivent de façon préférentielle les afférences nociceptives des fibres A delta.
- les neurones nociceptifs non-spécifiques (Wide Dynamic Range - WDR) qui pourraient être qualifiées de "pluri-réceptifs", de poly-convergents ou de convergents puisqu'ils reçoivent à la fois des influx sensitifs non-nociceptifs de tout type et des influx nociceptifs.
Ces WDR sont situés presqu'exclusivement dans la couche V de la corne postérieure et un peu dans la couche IV. Ils envoient cependant de longs prolongements dendritiques dans les couches III et IV (nucleus proprius) de la corne postérieure où ils "recueillent" les transferts synaptiques en provenance:
-
- des grosses fibres afférentes A alpha, A bêta (sensations tactiles et proprioceptives),
- des fibres A delta et C,
- des cellules pédonculées qui envoient d'abondants transferts synaptiques et dont il est fait mention plus loin.
- les neurones des mécanorécepteurs à faible seuil (Low-Threshold Mecano-Receptor - LTM).
INDIRECTEMENT c'est -à-dire par l'intermédiaire de petits neurones (2 types) avant d'atteindre le neurone central.
Les courts neurones servant d'interface ou de sous-circuits de connexions entre les neurones nociceptifs périphériques et les neurones centraux existent sous deux formes:
- de très courts neurones, des interneurones aussi appelés neurones intercalaires, qui eux, font synapse directement avec les dendrites d'un ou de plusieurs neurones nociceptifs centraux LMN et WDR. (Schéma de Véro - Gyn refait)
Ces interneurones sont situés presqu'exclusivement dans la couche I et II, i.e. dans la zone marginale et dans la substance gélatineuse de la corne postérieure.
- des neurones pédonculés (Stalk Cells (SC)) qui eux aussi font synapse directement avec les dendrites d'un ou de plusieurs neurones nociceptifs centraux LMN et WDR. (Schéma de Véro - Gyn refait)
Ces neurones pédonculés sont surtout situés dans la couche II et III, i.e. dans la substance gélatineuse (II) et dans la portion III du nucleus proprius (III-IV) de la corne postérieure.
57 - La "cour de triage" complexe: la spécificité des différents neurones centraux
Chaque type de neurones centraux a comme fonction de transporter certains types d'influx, ainsi:
-
les neurones "LMN/NS" transportent les influx nociceptifs
- thermiques
-
mécaniques
-
les neurones "WDR" transportent les influx sensitifs et nociceptifs de tout type et de toutes les structures
- toucher superficiel (light touch) et autres
-
douloureux quelconques
-
les neurones "LTM" transportent les influx tactiles
- toucher superficiel (light touch)
- pression
-
mobilisation des poils des surfaces cutanées pileuses (hair movement)
Chaque type de fibres peut ainsi recevoir à la fois des informations sensitives "non-nociceptives" et "nociceptives". Cette notion élargit encore le concept des douleurs référées puisque des influx "douloureux" provenant de structures viscérales et ostéo-articulaires peuvent alors converger vers le même type de fibre centrale et faire leur ascension vers les centres de relais et d'interprétation du tronc cérébral et du cerveau dans le même neurone central nociceptif.
58 - La "cour de triage" complexe:la fonction des interneurones et des neurones pédonculés
La fonction des interneurones et des neurones pédonculés est d'agir sur le transfert des influx nociceptifs de deux manières:
-
certains interneurones exercent un rôle d'inhibition sur le transfert des influx nociceptifs vers les neurones centraux dans la corne postérieure
-
d'autres, malheureusement!, viennent "faciliter" le transfert des influx nociceptifs dans la corne postérieure, on les qualifie de neurones "excitateurs".
La fonction d'inhibition est particulièrement importante. Elle se joue par l'intermédiaire des deux sous-circuits de connexion que sont les interneurones et les neurones pédonculés:
- les interneurones ou neurones intercalaires reçoivent leurs connexions synaptiques presqu'exclusivement en provenance des faisceaux dorso-latéraux qui sont des faisceaux inhibiteurs descendants. Ces faisceaux inhibiteurs descendants sont des faisceaux principalement sérotoninergiques et noradrénergiques qui proviennent de certaines régions corticales et sous-corticales du cerveau et de certaines structures du tronc cérébral i.e. dans l'ensemble des centres supra-spinaux (Voir: LA CONTREPARTIE DES FAISCEAUX ASCENDANTS: LES FAISCEAUX DESCENDANTS INHIBITEURS)
- Les interneurones utilisent des NTs "inhibiteurs" (enképhaline, dynorphine, norépinéphrine et GABA) et exercent leur inhibition de deux manières complémentaires, c'est-à-dire en faisant une inhibition:
-
pré-synaptique (sur le bouton pré-synaptique)
et - post-synaptique (sur la membrane du neurone central afférent suivant).
Ils font donc synapse avec
- les boutons pré-synaptiques des fibres A delta et C
- les membranes post-synaptiques des dendrites des neurones LMN
- les membranes post-synaptiques des dendrites des neurones WDR.
Comme il existe une très nette prépondérance de fibres C puisque celles-ci composent probablement autour de 60-90 % des afférences cutanées et presque la quasi totalité des afférences viscérales, on peut alors comprendre toute l'importance des faisceaux inhibiteurs descendants dans la réduction du transfert des influx nociceptifs en provenance de la périphérie.
- les neurones pédonculés reçoivent leurs connexions synaptiques à la fois des fibres A alpha, A bêta et des fibres C.
Ils utilisent des NTs "inhibiteurs" mais produisent aussi des NTs "excitateurs". Ils n'exercent leur inhibition que d'une seule manière soit en faisant une inhibition:
- post-synaptique exclusivement.
Ils font synapse avec
- les membranes post-synaptiques des dendrites des neurones LMN
- les membranes post-synaptiques des dendrites des neurones WDR.
Ces interactions sur la transmission des influx nociceptifs réfèrent au concept de "modulation". Le concept de modulation a été développé par Melzack et Wall sous le nom de "Théorie du portillon" (Gate Control Theory). et a été publié en 1965. Cette publication demeure un extraordinaire classique dans toute la littérature portant sur la douleur (Melzack R, Wall PD. Pain mechanism: a new theory. Science 1965; 150:971-9). Les opérations de modulation dans "la cour de triage" qu'est la corne postérieure sont complexes comme on pourra le constater.
59 - Les différents sous-circuits intermédiaires inhibiteurs de connexion: leurs neurotransmetteurs
Les interneurones dans leur fonction d'inhibition pré et post-synaptique font usage de cinq principaux NTs "inhibiteurs"
- l'enképhaline,
- la dynorphine,
- la norépinéphrine
- la sérotonine
- le GABA, l'acide gamma-amino-butyrique (GABA - gamma-amino-butyric acid)
alors que les cellules pédonculées (Stalk Cells) qui n'exercent leur inhibition qu'en post-synaptique font usage préférentiellement de trois
- l'enképhaline,
- la dynorphine,
- le GABA.
L'activation de ces neurones intermédiaires vient réduire de façon marqante le transfert d'influx douloureux dans la corne postérieure de sorte qu'il en résulte une moins grande abondance pouvant faire ascension vers le tronc cérébral et le cerveau.
60 - Les neurotransmetteurs inhibiteurs des différents sous-circuits intermédiaires de connexion: leurs modes d'action
Selon le mécanisme plusieurs fois proposé, les NTs "inhibiteurs" ainsi libérés (principalement: enképhaline, dynorphine, GABA) viennent activer les récepteurs "biochimiques" (enképhalinergiques, dynorphinergiques, GABAergiques) situés
- soit sur les boutons pré-synaptiques des fibres nociceptives
- soit sur les membranes post-synaptiques des neurones centraux.
Que cette activation se produise sur le bouton pré-synaptique ou directement sur la membrane du neurone central, l'effet est toujours le même soit une "HYPERPOLARISATION PROLONGÉE".
Cette "HYPERPOLARISATION PROLONGÉE" (Voir: LA TRANSMISSION D'UN INFLUX DANS L'ESPACE SYNAPTIQUE: LES NTs "INHIBITEURS", L'HYPERPOLARISATION ET LES EFFETS SUR LE BOUTON PRE-SYNAPTIQUE ET LE NEURONE CENTRAL) a pour effet d'empêcher le bouton pré-synaptique de réagir à l'arrivée d'un influx nociceptif. L'augmentation de l'activité métabolique intrinsèque entrainant la production et la libération de NT(s) nociceptifs ne peuvent donc pas avoir lieu et la neurotransmission nociceptive se trouve donc réduite considérablement.
Par ailleurs cette "HYPERPOLARISATION PROLONGÉE" aura pour effet d'empêcher la membrane du neurone central de réagir à l'arrivée des NTs qui ont pu encore être produits et libérés.
Par un mécanisme ou l'autre, l'activation des récepteurs "biochimiques" (enképhalinergiques, dynorphinergiques, GABAergiques) résulte finalement en une très nette réduction du nombre d'influx nociceptifs prenant la direction des centres supérieurs.
L'architecture "modulatrice" des influx nociceptifs retrouvée au niveau de la corne postérieure existe en fait d'une façon semblable au niveau du noyau spinal du trijumeau, l'équivalent de la corne postérieure pour les influx nociceptfs en provenance de la face.
Il existe aussi des mécanismes de modulation au niveau des zones de relais dans le tronc cérébral et dans le cerveau.
C'est donc dire la puissance que pourront jouer tant les influx physiques que psychiques dans la modulation des perceptions nociceptives et dans le rendu final qu'est alors "la douleur globale" ou "souffrance".
Les multiples synapses présentes au niveau de la corne postérieure utilisent une grande variété de neurotransmetteurs, c'est donc dire qu'il existe, au niveau des surfaces synaptiques des nombreuses structures impliquées (les boutons pré-synaptiques, les interneurones, les cellules pédonculés (Stalk Cells), les dendrites centraux et les surfaces membranaires des neurones centraux) des récepteurs "biochimiques" spécifiques pour chacun de ces différents neurotransmetteurs.
Parmi cette multitude de récepteurs "biochimiques" spécifiques, deux récepteurs à eux seuls occupent une très large place dans le chapitre de la nociception/douleur, ce sont
61 - Les récepteurs nociceptifs-clé: les récepteurs opiacés
L'opium est connu depuis des siècles pour ses effets analgésiques. Depuis 1852, la morphine est connue et utilisée pour ces mêmes effets. Ce n'est pourtant qu'en 1960 qu'il a été possible de commencer à identifier certains sites d'action des substances opiacés au niveau du cerveau.
Quelques substances opiacés endogènes sont aujourd'hui connues:
-
les
 -endorphines qui sont des substances "hormonales" circulantes et qu'on retrouve donc en circulation dans le liquide céphalo-rachidien, elles sont sécrétées par le complexe hypothalamo-hypophysaire,
-endorphines qui sont des substances "hormonales" circulantes et qu'on retrouve donc en circulation dans le liquide céphalo-rachidien, elles sont sécrétées par le complexe hypothalamo-hypophysaire,
-
les enképhalines qui sont en fait des neurotransmetteurs synaptiques et qui n'existent pas dans la circulation sanguine
et
- la dynorphine qui est aussi un neurotransmetteur synaptique, donc absente de la circulation sanguine.
62 - Les récepteurs opiacés: leurs localisations centrales
Les techniques de micro-injections ont permis d'identifier trois sites particulièrement actifs dans le blocage des influx nociceptifs i.e. de la douleur, ce sont:
-
la substance grise périaqueducale (SGPA) (Periaquaductal Gray Matter-PAGM)
-
les noyaux bulbaires centraux (Midline Medullary Nuclei) comprenant
-
le noyau locus coeruleus
et - les noyaux médullaires du raphé "Nucleus Raphe Magnus
-
le noyau locus coeruleus
- la corne postérieure et son équivalent pour l'innervation crânienne, le noyau spinal du trijumeau. La corne postérieure comme site d'inhibition de la transmission des influx nociceptifs n'a été identifié qu'au milieu des années 1970.
Il existe de nombreuses autres localisations dans le système nerveux central où des récepteurs opiacés se retrouvent, mais leur stimulation ne provoque généralement pas d'effet analgésique. D'autres effets sont alors produits lors de leur stimulation. On retrouve ainsi des récepteurs opiacés au niveau
-
du thalamus
-
dans divers noyaux du tronc cérébral
- le centre du vomissement
- la zone gâchette (ZG) (chemotactic trigger zone - CTZ)
- le centre de la respiration.
Des récepteurs opiacés sont aussi présents en grand nombre au niveau
-
du système limbique (gestionnaire de nos émotions)
et - de l'hypothalamus (origine et gestionnaire du système nerveux autonome).
Enfin, il existe aussi des récepteurs opiacés au niveau des noyaux gris centraux (caudé, putamen et claustrum), des couches I et III du cortex cérébral et des zones périventriculaires.
Bien que la stimulation des récepteurs opiacés dans ces différentes régions ne provoquent pas d'analgésie, leur participation touche alors de nombreuses autres modalités parmi lesquelles se retrouvent:
- les changements de comportement,
- les changements d'humeur,
- l'éveil, la vigilance, le sommeil,
- les nausées et vomissements,
- la dépression respiratoire,
- la suppression de la toux.
63 - Les récepteurs opiacés: leurs localisations centrales "structurelles"
En fait, ces sites "particulièrement actifs dans le blocage des influx nociceptifs" sont les endroits où se trouvent des récepteurs "biochimiques" de type opiacé en très grande concentration. On retrouve ces récepteurs "OPIACES" à deux niveaux structurels:
-
au niveau de la paroi latérale des boutons pré-synaptiques
et
- au niveau de la membrane post-synaptique des neurones nociceptifs centraux de même qu'au niveau de la paroi latérale de ces mêmes neurones centraux i.e. au niveau de surfaces non-impliquées dans les échanges synaptiques.
Le marquage radioactif de ligands opiacés (agonistes) montre qu'il existe une répartition inégale des récepteurs opiacés au niveau de la corne postérieure. Ainsi, il est estimé que les récepteurs opiacés prédominent très nettement dans les couches I et II de la corne postérieure. De même, leur distribution domine très nettement au niveau des boutons pré-synaptiques avec une prévalence d'environ 70% alors que l'autre 30% se retrouve au niveau des membranes post-synaptiques.
On pourra alors déduire que les transferts nociceptifs impliquant les autres couches que les couches I et II ne répondront que très peu aux opiacés.
Par ailleurs, les récepteurs opiacés sont presqu'exclusivement situés sur les boutons pré-synaptiques des fibres C. Les fibres A delta ne possèdent que très peu de récepteurs opiacés sur leur bouton présynaptique. Ainsi lorsque les fibres A delta participeront à l'allodynie, sera-t-il vain d'espérer un blocage quelconque du transfert nociceptif provenant de la participation des fibres A delta par les opiacés.
64 - Les récepteurs opiacés: leurs localisations périphériques
Des récepteurs opiacés sont aussi présents en périphérie dans plusieurs sites. On en retrouve particulièrement au niveau
-
des plexus myentériques de l'intestin, c'est d'ailleurs ce qui explique la constipation TOUJOURS présente chez tout utilisateur d'opiacé,
-
des muscles lisses des sphincters, (iris, Oddi, pylore, sphincter interne de la vessie, sphincter interne de l'anus) ce qui explique à titre d'exemple la rétention urinaire chez les hommes avec une hypertrophie prostatique, le sphincter interne devenant alors hypertonique alors que l'hypertrophie causait déjà une obstruction partielle à la vidange de la vessie,
-
des mastocytes. Pratiquement tous les opiacés sont reconnus pour entraîner la libération d'histamine mais à des degrés variables. Seul le FENTANYL semble exempté de cet effet. La manifestation clinique la plus fréquente en rapport avec cet effet est le prurit qui se rencontre à l'occasion lorsque les opiacés courants sont prescrits. Les réactions allergiques plus sévères pouvant aller jusqu'au choc anaphylactique sont possibles mais extrêmement rares,
- des nocicepteurs, d'où la possibilité d'utiliser des opiacés en vaporisation sur certaines plaies "ouvertes".
A une exception près, soit en vaporisation sur des plaies "ouvertes", les opiacés n'exercent pas d'action ANALGESIQUE en périphérie. Cependant, la stimulation de ces récepteurs produit d'autres types d'effets, comme par exemple la constipation lorsque les récepteurs opiacés du système digestif sont stimulés. Lors de la prise d'opiacés PerOs, tous les récepteurs opiacés périphériques se trouvent alors stimulés avec les conséquences que l'on verra dans le document IV portant sur la gestion analgésique avec les opiacés.
65 - Les récepteurs opiacés: différents types
Il existe une variété de récepteurs opiacés avec des spécificités particulières. On connaît actuellement 5 grandes classes de récepteurs opiacés: les récepteurs MU, DELTA, SIGMA, KAPPA et EPSILON, les récepteurs mu se divisent en deux sous-classes mu-1 et mu-2. Chaque type de récepteur est responsable de provoquer des effets différents et spécifiques lorsqu'il est stimulé.
Les opiacés endogènes (enképhalines, bêta-endorphines, dynorphines) n'ont pas de sélectivité (ou de spécificité) pour aucun type de récepteur opiacés cependant ils possèdent une affinité différente pour chacun des types de récepteurs.
Ce sont les récepteurs mu-1 qui entraînent les effets analgésiques s'apparentant à l'analgésie provoquée par la morphine. La stimulation des autres types de récepteurs provoque différents effets, la plupart du temps indésirables, l'effet sur les différentes récepteurs opiacés peut ainsi être résumé:
|
• |
- analgésie de type morphinique
|
|
• |
- dépression respiratoire (les récepteurs dans le centre de la respiration perdent leur sensibilité au CO2) - euphorie - dépendance physique - ralentissement du transit digestif = constipation (récepteurs périphériques) |
|
• |
- analgésie par des substances non commercialisées (recherche)
|
|
• |
- stimulation du système nerveux autonome - dysphorie - agitation - délire - hallucinations |
|
• |
- analgésie de type pentazocine - sédation - miose |
|
• |
- analgésie |
D'autres subdivisions pour presque chacun des différents récepteurs opioïdes sont maintenant connues, leur application clinique est loin d'être encore évidente.
Trois récepteurs opiacés sont donc liés à une réduction de la douleur lorsqu'ils sont stimulés. Ce sont les récepteurs auxquels il est le plus souvent fait mention, ce sont les récepteurs:
- •
1
•
•
Les récepteurs opiacés sont distribués en de multiples régions, autant au niveau du système nerveux central qu'en périphérie dans diverses structures et viscères.
On ne connaît pas la distribution relative des principaux récepteurs MU, KAPPA et DELTA chez l'homme mais il est certain que les récepteurs MU dominent très largement.
66 - Les récepteurs opiacés centraux: les effets produits par leur stimulation au niveau médullaire
Lorsque les récepteurs opiacés centraux du réseau nociceptif sont stimulés, il se produit alors des effets grandement bénéfiques sur le plan analgésique.
Au niveau médullaire ainsi qu'au niveau de son équivalent "tronculaire", le noyau spinal du trijumeau, la stimulation des récepteurs opiacés peut se faire à deux niveaux: les boutons pré-synaptiques et les membranes post-synaptiques.
-
• Sur les boutons pré-synaptiques des fibres nociceptives périphériques, la stimulation des récepteurs opiacés MU et DELTA produit (Voir: LA TRANSMISSION D'UN INFLUX DANS L'ESPACE SYNAPTIQUE: LES NTs "INHIBITEURS", L'HYPERPOLARISATION ET LES EFFETS SUR LE BOUTON PRE-SYNAPTIQUE ET LE NEURONE CENTRAL)
• un blocage partiel du transfert des influx nociceptifs au niveau des multiples synapses en réduisant la production et la libération de la substance P, du glutamate et des autres neurotransmetteurs nociceptifs.
En fait, l'activation des récepteurs opiacés (enképhalinergiques et dynorphinergiques) entraîne alors• une ouverture d'un certain nombre de canaux "ioniques" parmi les canaux chloriques (Cl-) et potassiques (K+) ce qui amène une migration des ions (Cl-) en intra-cellulaire et des ions (K+) en extra-cellulaire.
Ces migrations ont pour effet d'entraîner à leur tour
• une accentuation de la charge négative intracellulaire ce qui se traduit par une augmentation du potentiel transmembranaire i.e. une hyperpolarisation
Cette hyperpolarisation a pour effet à son tour
• d'inhiber la réponse des canaux calciques "voltage dépendants" lors de l'arrivée d'un influx électrique. En situation d'activation normale, l'arrivée d'un influx électrique au niveau du bouton pré-synaptique provoque l'ouverture d'un certain nombre de canaux calciques (Ca++) situés sur la membrane du bouton pré-synaptique. L'arrivée massive de (Ca++) à l'intérieur du bouton active de façon intensive l'usine métabolique intrinsèque à ce niveau ce qui a pour effet de faciliter la production massive de neurotransmetteurs qui sont alors libérés en quantité "déterminée", cette quantité déterminée ayant pour nom: "quantum".
En fait, les événements ainsi décrits pourraient se résumer de la façon suivante: moins de production de neurotransmetteurs "nociceptifs" (subtstance P et autres), moins de libération, moins de libération, moins de transmission "nociceptive" dans l'espace synaptique.
• Sur les membranes post-synaptiques, la stimulation des récepteurs opiacés MU et DELTA produit (Voir: LA TRANSMISSION D'UN INFLUX DANS L'ESPACE SYNAPTIQUE: LES NTs "INHIBITEURS", L'HYPERPOLARISATION ET LES EFFETS SUR LE BOUTON PRE-SYNAPTIQUE ET LE NEURONE CENTRAL)
• une très nette réduction du nombre d'influx nociceptifs prenant la direction des centres supérieurs.
En fait, l'activation des récepteurs opiacés (enképhalinergiques et dynorphinergiques) sur les membranes post-synaptiques des neurones centraux entraîne alors (tout comme dans le cas de l'activation des récepteurs opiacés présents sur les boutons pré-synaptiques)• une ouverture d'un certain nombre de canaux "ioniques" parmi les canaux chloriques (Cl-) et potassiques (K+) ce qui amène une migration des ions (Cl-) en intra-cellulaire et des ions (K+) en extra-cellulaire.
Ces migrations ont pour effet d'entraîner à leur tour
• une accentuation de la charge négative intracellulaire ce qui se traduit par une augmentation du potentiel transmembranaire i.e. une hyperpolarisation "prolongée" d'une région de la membrane post-synaptique des dendrites "nociceptifs" centraux. Comme il existe une abondance de récepteurs opiacés à ce niveau, c'est finalement une large surface de la membrane post-synaptique qui se trouve ainsi "hyperpolarisée".
Cette hyperpolarisation a pour effet à son tour• de réduire la réponse de la membrane neuronale lorsque des neurotransmetteurs "excitateurs" se fixent à sa surface puisque le potentiel transmembranaire constituant le point de départ de cette nouvelle dépolarisation est maintenant beaucoup plus NÉGATIF qu'auparavant c'est-à-dire encore plus négatif que le potentiel de repos appartenant à ces neurones (Voir: LE PHENOMENE DE DEPOLARISATION "MEMBRANAIRE" et LE PHENOMENE DE L'HYPERPOLARISATION "MEMBRANAIRE").
La membrane post-synaptique devient donc "moins répondante" aux NTs nociceptifs libérés puisqu'il devient plus difficile d'atteindre le seuil d'activation suffisant pour déclencher un influx nociceptif.Cependant, contrairement à la région pré-synaptique, l'activation des récepteurs opiacés sur les membranes post-synaptiques des neurones centraux n'a pas d'effets sur les canaux calciques "voltage dépendant". L'activation des récepteurs opiacés des membranes post-synaptiques n'entraîne donc pas d'inhibition de la réponse de ces canaux.
La stimulation des récepteurs opiacés KAPPA produit pour sa part elle aussi
-
• un blocage partiel du transfert des influx nociceptifs au niveau des multiples synapses en réduisant la production et la libération de la substance P, du glutamate et des autres neurotransmetteurs nociceptifs.
Cet effet est aussi produit par
• une ouverture d'un certain nombre de canaux "ioniques" parmi les canaux chloriques (Cl-) et potassiques (K+) ce qui amène une migration des ions (Cl-) en intra-cellulaire et des ions (K+) en extra-cellulaire qui se traduit par une augmentation du potentiel transmembranaire i.e. une hyperpolarisation qui a pour effet à son tour d'inhiber la réponse des canaux calciques "voltage dépendants" lors de l'arrivée d'un influx électrique.
Mais, en fait, l'activation des récepteurs opiacés KAPPA a principalement pour effet d'entraîner une fermeture des canaux Ca++.
Les principales substances opiacées "inhibitrices", c'est-à-dire celles qui ont pour effet de diminuer le transfert d'influx nociceptifs sont principalement de trois types: enképhalines, dynorphines et bêta-endorphines.
On constate donc que les opiacés "commercialement disponibles" agissent tel les NTs "inhibiteurs" opioïdes naturels (enképhalines, dynorphines et bêta-endorphines) (Voir: LA CORNE POSTERIEURE: UNE "COUR DE TRIAGE" COMPLEXE). Ils activent les récepteurs opiacés situés en diverses régions anatomiques du SNC.
A titre d'exemple, la morphine exerce préférentiellement ses effets sur les récepteurs MU. Cette substance est considérée comme un agoniste relativement sélectif des récepteurs MU puisque son affinité pour les récepteurs DELTA est 50X moindre et que son affinité pour les récepteurs KAPPA est négligeable. C'est donc dire que la morphine exerce son effet de préférence en produisant une ouverture des canaux potassiques (K+) qu'en provoquant directement la fermeture des canaux calciques (Ca++). Le fentanyl pour sa part possède une affinité presqu'exclusive pour les récepteurs MU et n'a donc que très peu d'effet direct sur les canaux calciques.
67 - Les récepteurs opiacés centraux: les effets produits par leur stimulation au niveau du mésencéphale et du tronc cérébral
Au niveau du tronc cérébral et du mésencéphale, i.e. au niveau de certains noyaux
- noyau ceruleus (nucleus ceruleus) de la protubérance (pons)
- noyau raphé magnus (nucleus raphe magnus) du bulbe (medulla)
-
noyau réticulaire latéral (nucleus reticularis lateralis) dans la portion latérale de la formation réticulée,
la stimulation des récepteurs opiacés présents génère
-
la production d'influx inhibiteurs descendants qui viennent alors accentuer l'effet "portillon". Ces influx inhibiteurs sont véhiculés par les faisceaux descendants inhibiteurs qui seront décrits plus loin. (Voir: LA CONTREPARTIE DES FAISCEAUX ASCENDANTS: LES FAISCEAUX DESCENDANTS INHIBITEURS).
On constate donc que la stimulation des récepteurs opiacés, où qu'ils se trouvent au niveau du tronc cérébral, entraînent des effets qui sont toujours convergeants en regard de l'analgésie. Là où ils se trouvent, naissent des influx inhibiteurs descendants qui vont être véhiculés par des sous-faisceaux vers les étages médullaires inférieurs.
C'est au niveau de la corne postérieure, décrite comme une cour de triage fort complexe, que l'effet des opiacés est donc particulièrement "dirigé" et "aiguillonné". Le blocage des douleurs par les opiacés n'est donc pas un effet cérébral en soi, mais bien un effet médullaire. En fait, une très large part de l'analgésie semble se jouer au niveau de la corne postérieure.
Tout concourt donc, dans l'aiguillonnage à l'étage médullaire, à ce que moins de douleur soit ressentie! C'est l'effet portillon dont il sera discuté plus loin.
68 - Le blocage des influx nociceptifs: les récepteurs non-opioïdes
Tel que décrit précédemment, le blocage d'une large portion des influx nociceptifs i.e. l'effet analgésique, se fait par une action des opiacés sur les récepteurs opiacés situés sur les boutons pré-synaptiques et sur les membranes post-synaptiques des fibres nociceptives.
Ce transferts des influx nociceptifs est donc particulièrement sensible aux opiacés pour une large portion des influx nociceptifs tel que la clinique nous l'enseigne jour après jour. Cependant, certains transferts nociceptifs ne présentent pas ou présentent peu de sensibilité aux opiacés alors qu'ils sont sensibles à d'autres substances. Il faut comprendre qu'il existe au niveau de la biochimie des neurones périphériques et des neurones centraux d'autres réseaux de blocage des transferts nociceptifs situés eux aussi sur les boutons pré-synaptiques et sur les membranes post-synaptiques mais différents des récepteurs opiacés. Ces réseaux sont qualifiés de non-opioïdes. Plusieurs "NTs" autres que les opioïdes sont actuellement identifiés comme bloquant les influx nociceptifs:
- sérotonine
- norépinéphrine
- acide gamma-amino-butyrique (GABA - gamma-amino-butyric acid)
- neurotensine
- acétylcholine.
Cet effet analgésique "final" se fait sensiblement par les mêmes mécanismes que celui des opiacés:
- différents récepteurs "biochimiques" autres que les récepteurs opiacés sont présents sur les boutons pré-synaptiques et sur les membranes post-synaptiques des fibres nociceptives et sont comme "en attente de leur substance ou ligand spécifique",
- l'arrivée de "la substance spécifique" qui se fixe alors sur les récepteurs dédiés à cette substance et activation des récepteurs,
- au niveau des boutons pré-synaptiques, hyperpolarisation d'une partie de la membrane, non atteinte du potentiel transmembranaire permettant l'ouverture des canaux sodiques et calciques "voltage-dépendants", non déclenchement de la cascade de réactions biochimiques à l'intérieur des boutons pré-synaptiques et donc inhibition de la production et de la libération des NTs nociceptifs spécifiques
- au niveau de la membrane post-synaptique, hyperpolarisation de cette membrane la rendant "non réceptive" aux NTs nociceptifs libérés.
-
-
Résultat final:
- absence ou réduction très nette de transmission d'influx nociceptifs à partir du neurone périphérique vers le neurone central.
Les voies pour arriver à l'effet final peuvent découler de différents mécanismes, ainsi les antidépresseurs bloquent d'abord la recaptation de sérotonine ou de norépinéphrine pour ensuite entrainer les effets décrits plus haut. D'autres substances bloquent directement certains canaux ioniques, toujours en agissant sur un récepteur spécifique, réduisant de ce fait la dépolarisation voire l'arrivée massive de Ca++ dans les neurones nociceptifs.
Une meilleure connaissance des NTs modulant de façon inhibitrice la douleur de même que des substances exerçant un effet coanalgésique devrait permettre d'ouvrir la voie à des applications cliniques "rationnelles" de gestion analgésique. Des substances parfois encore au stade de la recherche sont actuellement disponibles en regard de presque tous les NTs inhibiteurs décrits ci-haut. L'avenir nous dira lesquels seront les plus efficaces.
A titre d'exemple,
-
les récepteurs opioïdes
 1 sont sensibles à la morphine
1 sont sensibles à la morphine
-
les récepteurs opioïdes
 sont sensibles à une substance codée DADL
sont sensibles à une substance codée DADL
-
les récepteurs opioïdes
 sont sensibles à une substance codée U50488H
sont sensibles à une substance codée U50488H
-
les récepteurs adrénergiques
 -1 (NE) sont sensibles à la méthoxamine
-1 (NE) sont sensibles à la méthoxamine
-
les récepteurs adrénergiques
 -2 (NE) sont sensibles à la clonidine
-2 (NE) sont sensibles à la clonidine
-
les récepteurs adrénergiques
 (E) sont sensibles à l'isoprotérénol
(E) sont sensibles à l'isoprotérénol
- les récepteurs sérotoninergiques 5-HT sont sensibles à la sérotonine
- les récepteurs gabaergiques GABA1 ou GABAA sont sensibles au muscimol
- les récepteurs gabaergiques GABA2 ou GABAB sont sensibles au baclofen
- les récepteurs NEUROTENSIN sont sensibles au neurotensin
- les récepteurs CHOLINERGIQUE (AC) sont sensibles à l'oxotremorine.
Plusieurs utilisations "cliniques" sont donc susceptibles de voir le jour dans les années qui viennent en se basant sur l'espoir que des molécules utilisables chez l'humain et dévolues d'effets secondaires soient développées.
Il faut rappeler enfin un autre élément de complexité en rapport avec chaque type de substances à savoir qu'il peut exister:
- un ou plusieurs sous-types de récepteurs pour chaque substance
- une ou plusieurs substances endogènes peuvent se fixer sur ces récepteurs
- une ou plusieurs substances exogènes aussi se fixer sur ces récepteurs pour entrainer parfois des effets indésirables.
Pour le moment, en regard d'un effet recherché sur un des récepteurs énumérés plus haut, ce sont les opiacés qui sont utilisés le plus couramment en pharmacothérapie clinique pour la visée analgésique. En deuxième lieu, ce sont les antidépresseurs. D'autres substances apparaîtront ultérieurement sur le marché parce que plus d'une voie inhibitrice est maintenant connue. Cependant, une des limites au développement de ces nouvelles substances dotées d'effets analgésiques concerne l'absence d'effet analgésique lorsqu'administrées oralement ou la trop grande importance des effets secondaires. La plupart des substances nouvellement utilisées pour leur effet analgésique nécessitent en effet une administration épidurale ou intra-thécale pour obtenir leur vraie puissance analgésique (baclofen, clonidine), ce qui vient limiter leur usage considérablement pour le moment.
69 - Les récepteurs nociceptifs-clé: les récepteurs NMDA et ...les récepteurs non-NMDA
La transmission de la douleur se fait de façon préférentielle par les synapses utilisant la substance P et le glutamate comme neurotransmetteurs. La substance P est un peptide qui agit comme neurotransmetteur "excitateur". Les récepteurs pour la "substance P" au niveau de la membrane post-synaptique des dendrites centraux sont les récepteurs NK-1, trois sous-types de récepteurs NK-1 sont connus au niveau de la membrane post-synaptique des neurones nociceptifs centraux.
L'autre réseau bien connu de communication nociceptive utilise le glutamate. Le réseau "glutamate" est dotés de récepteurs glutamate de type NMDA (N-methyl-D-aspartate) et de type NON-NMDA.
Les récepteurs NMDA sont des récepteurs situés à la surface des canaux ioniques calciques.
Les récepteurs NON-NMDA sont de trois types selon les substances auxquels ils réagissent en plus de réagir au glutamate et à l'aspartate:
- les récepteurs quisnalate-kainate (Q/K) sont des récepteurs situés à la surface des canaux ioniques,
- les AMPA (alpha-methyl-propionic acid) sont aussi des récepteurs situés à la surface des canaux ioniques,
- les métabotropiques sont des récepteurs membranaires utilisant une protéine G comme intermédiaire.
70 - Les récepteurs NMDA et ...les récepteurs non-NMDA: leurs rôles en situation normale
Les récepteurs NMDA et deux récepteurs NON-NMDA (Q/K et AMPA) sur trois figurent parmi les récepteurs "biochimiques" situés à la surface des canaux ioniques (Ca++, Na+ et K+) des membranes post-synaptiques des neurones et des dendrites centraux nociceptifs. Les canaux ioniques munis de récepteurs NMDA possèdent une grande perméabilité pour les trois ions (Ca++, Na+ et K+). Seul un des récepteurs NON-NMDA parmi les trois connus est membranaire, on y réfère comme le récepteur NON-NMDA métabotropique. Les récepteurs NON-NMDA et NMDA font partie des réseaux de transferts utilisant des substances autres que la substance P comme NT nociceptif. Les récepteurs NMDA et NON-NMDA sont tous activés par le glutamate, un des NTs nociceptifs excitateurs. Ils se comportent cependant de façon différente; les récepteurs NMDA pour leur part, ne sont activés qu'en situations particulières comme il en sera fait mention dans ce qui suit.
Il faut d'abord préciser, pour commencer, que les récepteurs NMDA ne participent pas aux échanges synaptiques nociceptifs en temps normal. Ils ne participent donc pas à la dépolarisation de la membrane post-synaptique des neurones centraux. Ils y participent uniquement lorsque le flot d'influx nociceptifs arrivant à la corne postérieure devient très très important et soutenu. Ces deux conditions sont essentielles. Par ailleurs, cette très nette accentuation du flot d'influx nociceptifs provient presqu'exclusivement des fibres C.
Les récepteurs NON-NMDA sont plus nombreux que les NMDA à la surface de la membrane post-synaptique des neurones et des dendrites centraux nociceptifs. Ils sont habituellement localisés proche à proche un de l'autre, comme "de mauvais complices". En situation de transmission nociceptive "normale", du glutamate et de la sP sont libérés par la membrane synaptique des boutons pré-synaptiques des fibres nociceptives périphériques. Ce glutamate se fixe sur les récepteurs NMDA et NON-NMDA. Il active normalement les récepteurs NON-NMDA et les canaux ioniques s'ouvrent alors pour contribuer à la dépolarisation progressive de la membrane environnante. Les récepteurs NMDA pour leur part résistent à l'activation par le glutamate, en situation normale, en raison du fait que ce type de récepteur nécessite une certaine valeur de dépolarisation dans l'environnement immédiat avant de s'ouvrir, cela étant dû à la présence de l'ion Mg++ présent dans le canal ionique et qui fait obstruction à l'ouverture de ce même canal avant qu'une certaine valeur de dépolarisation ne soit atteinte. Lorsque cette valeur de dépolarisation est atteinte, cela a pour effet de faire "sauter" l'ion Mg++, un peu à l'exemple d'un bouchon d'une bouteille de champagne qu'on fait "sauter".
71 - Les récepteurs NMDA et ...les récepteurs non-NMDA: leurs rôles en situation d'hyperactivité périphérique
Les récepteurs NMDA jouent un rôle particulier lors des phénomènes d'hyperstimulation (ou hyperexcitation) nociceptive "d'origine périphérique". Cette hyperstimulation d'origine périphérique provient le plus souvent de contexte
- inflammatoire,
- ischémique
- neurogène.
L'hyperstimulation d'origine périphérique mène alors à une situation d'hyperactivité dans la neurotransmission nociceptive au niveau des synapses de la corne postérieure. En fait, lorsque les neurones nociceptifs centraux de la corne postérieure reçoivent un surplus d'influx nociceptifs en provenance de la périphérie, les membranes post-synaptiques deviennent alors hyperexcitables et cette "hyperexcitabilité" se prolonge parfois plusieurs heures sans qu'il ne soit nécessaire de maintenir aucune hyperstimulation nociceptive. Les récepteurs NMDA jouent un rôle particulier autant pour ce qui est de la portion "initiation" de ces phénomènes que de la portion "maintien".
En situation d'hyperexcitation d'origine périphérique, tous les neurones nociceptifs centraux deviennent même hypersensibles à tous les types d'influx "sensitifs" qu'ils reçoivent, il n'est donc plus nécessaire d'avoir une stimulation "véritablement" nociceptive pour que les neurones nociceptifs centraux signalent de la douleur vers les régions supérieures. C'est donc dire qu'ils se mettent à réagir à plusieurs types de NTs impliqués dans la neurotransmission des influx sensitifs "non-nociceptifs". Ces mêmes neurones centraux deviennent donc en fait extrêmement faciles à activer.
Que s'est-il donc produit alors ?
Dans les circonstances d'hyperstimulation nociceptive intense et soutenue, la membrane post-synaptique est soumise à un bombardement de NTs nociceptifs de plusieurs types. En fait, les terminaisons pré-synaptiques sont capables de produire plusieurs types de NTs en situation d'hyperstimulation. Le glutamate, devenu "hyperprésent" pour sa part, s'est alors mis à déclencher une intense dépolarisation des récepteurs NON-NMDA, qui sont situés "malheureusement" à proximité des récepteurs NMDA. Ce bombardement "à haute fréquence nociceptive" produit une accentuation très nette des phénomènes de dépolarisations dans la membrane post-synaptique au pourtour immédiat des récepteurs NMDA. Lorsque le voltage transmembranaire atteint une certaine valeur de dépolarisation "cible" au pourtour immédiat des récepteurs NMDA et qu'en même temps ce dernier est soumis à un intense bombardement au glutamate, l'ion Mg++, présent dans le canal ionique (des récepteurs NMDA) et qui faisait obstruction à l'ouverture de ces mêmes canaux ioniques, est délogé de sa position. Le bouchon "vient de sauter"! Ce n'est pourtant pas le début de la fête, c'est plutôt le début de la catastrophe!
Pour que les récepteurs NMDA s'ouvrent, il aura donc fallu plusieurs conditions en même temps:
- un "excès" de glutamate,
- une hyperactivation des récepteurs NON-NMDA
- un débordement de dépolarisation au pourtour des NMDA,
- l'atteinte d'un voltage transmembranaire "cible" au pourtour des NMDA.
Les canaux ioniques munis de récepteurs NMDA sont uniques sous cet aspect. Ils doivent donc subir une double "régulation" ou "activation" pour s'ouvrir.
Lorsque les canaux ioniques munis de récepteurs NMDA sont enfin ouverts i.e. lorsque le "bouchon Mg++" est supprimé, commence alors, à travers ces canaux ioniques un flot incessant de Na+ et de Ca++ migrant vers l'intérieur des neurones centraux, le tout s'accompagnant d'un flot incessant de K+ migrant à l'extérieur. Ce flot incessant produit une dépolarisation de plus en plus massive dans les zones membranaires concernées et donc une hyperexcitabilité de plus en plus marquée et de plus en plus étendue à ces mêmes niveaux. Une fois que les récepteurs NMDA ont commencé à être activés, le phénomène d'hyperexcitabilité est long à s'éteindre étant donné certains mécanismes d'autoentretien de l'hyperexcitabilité que les récepteurs NMDA induisent. En effet, les NMDA réussissent:
- non seulement à réduire la charge négative intracellulaire, qui peut alors passer, à titre d'exemple, de - 70 mV à - 15 mV,
- à maintenir ce potentiel transmembranaire à ces mêmes valeurs pendant longtemps.
A des valeurs de - 15 mV toujours à titre d'exemple, il ne faut que de très faibles stimuli pour déclencher des trains d'activations d'influx et les membranes post-synaptiques des neurones centraux nociceptifs et même que de leur portion dendritique répondent alors à la moindre arrivée d'influx nociceptifs par les fibres C dans la corne postérieure.
72 - Les récepteurs NMDA et ...les récepteurs non-NMDA: leurs rôles dans le "maintien" d'une hyperactivation des dendrites centraux
Comment peut donc se faire ce "maintien" d'une hyperactivation neuronale centrale ?
Sur le plan de la biochimie neuronale, cette irritabilité membranaire "facilitée" au point de devenir "spontanée ou autodéclenchable" provient de l'arrivée massive et continue d'ions Ca++ à l'intérieur des neurones centraux ce qui a comme conséquence d'entrainer un taux anormalement élevé de Ca++. Lorsque le Ca++ migre de façon massive à l'intérieur des boutons dendritiques et du corps cellulaire des neurones nociceptifs centraux, il active une cascade d'activités biochimiques qui concourent toutes à l'accentuation des douleurs.
De nombreuses structures et de nombreux processus intracellulaires sont reconnus comme dépendants du Ca++ intracellulaire, parmi ceux-ci figurent:
-
le réticulum endoplasmique, responsable entre autre d'assurer les réserves de Ca++ intracellulaires et qui sous l'influence d'une augmentation de Ca++ en provenance de l'ouverture des NMDA inonde l'espace intracellulaire d'une plus grande quantité de Ca++ encore ce qui a pour effet de contribuer à un effet de cercle vicieux en regard de l'activation des différentes cascades biochimiques dépendants du Ca++ déjà en cours,
-
l'augmentation de l'activité de la Phospholipase A qui se trouve nettement accentuée, ce qui entraîne une augmentation de production et de libération d'acide arachidonique. Cet acide arachidonique migre par la suite à partir du corps cellulaire de la cellule centrale vers le bouton présynaptique où il fait ensuite son entrée. Il deviendra le substrat de la cyclo-oxygénase activée à son tour par le NO ce qui entraînera l'augmentation de production de prostaglandine (PG),
-
l'augmentation de l'activité du complexe mGLU-R - ProtG ce qui augmente l'activation de la Phospholipase C qui augmente alors sa production de DAG (diacylglycérol) et IP3 (inositol triphosphate). L'augmentation d'IP3 active à son tour le Réticulum endoplasmique qui inonde encore plus l'espace intracellulaire d'une plus grande quantité de Ca++ encore et l'effet de cercle vicieux ne fait que s'accentuer,
-
l'augmentation de l'activité de la Protein kinase C, ce qui a pour effet d'augmenter la phosphorylation des canaux AMPA, Q/K, NMDA et donc l'activité de ces mêmes récepteurs ce qui aura pour effet d'amener encore plus de Ca++ dans le corps cellulaire du neurone central et donc d'augmenter encore plus l'activité de la NO synthétase,
-
l'augmentation de l'activité de la Protein kinase dépendant de l'enzyme Ca++/Ca-Modulin (CaM) ce qui aura pour effet d'augementer encore plus l'activité de la NO synthétase,
-
l'augmentation de l'activité de l'Ornithine decarboxylase (ODC) ce qui aura pour effet d'augmenter la production de bioamines (polyamines). Tout comme pour l'acide arachidonique, ces bioamines (polyamines) seront libérées en dehors du corps cellulaire du neurone central et migreront vers l'espace synaptique où ils se fixeront sur les canaux NMDA sur un site qui leur est spécifique,
-
l'activité de certaines Protéases et Endonucléases présentes dans le noyau. L'hyperactivation de ces différents enzymes aura pour effet d'accélérer la dégénérescence cellulaire et de mener à la mort cellulaire (apoptose) de certains neurones centraux et de certains interneurones,
-
l'augmentation de l'activité des mitochondries ce qui aura pour effet de mener à une accélération de la dégénérescence mitochondriale et donc à la mort cellulaire (apoptose) de certains neurones centraux et de certains interneurones,
- l'augmentation de l'activité de la NO synthétase ce qui aura pour effet d'entraîner à l'intérieur du corps cellulaire des neurones centraux une importante production d'une substance gazeuse, le monoxyde d'azote (NO), qui agira comme substance "facilitatrice" ou "amplificatrice" pour de nombreuses réactions biochimiques.
Il ne sera donc pas étonnant que l'ensemble de ces réactions mènent à un épuisement cellulaire et à une mort cellulaire (apoptose) à plus ou moins court terme tellement l'hyperactivation est intense et continue. On assistera alors au dérèglement complet d'une partie de l'architecture des différentes structures nociceptives et cela touchera autant les neurones nociceptifs que leurs constituants intra-cellulaires, autant les neurones modulateurs que leurs constituants intra-cellulaires. Ces différentes transformations concoureront aux changements dits de plasticité dont il sera fait mention ultérieurement. (Voir: LES LESIONS NERVEUSES: LES DIFFERENTES ANOMALIES PATHOPHYSIOLOGIQUES A MOYEN ET LONG TERME / LESIONS NERVEUSES: PROCESSUS DE REGENERATION NEURONALE ET CONCEPT DE PLASTICITE NEURONALE)
A travers ces processus, il se trouve deux enzymes "kinase" qui sont particulièrement impliquées dans l'hyperactivation des différents métabolismes. Ces kinases ont pour effet d'augmenter la production de substances dites "seconds messagers" (NO, cGMP et autres) dont l'effet, "en excès" devient toxique pour la cellule. En fait, ces deux enzymes (Ca++/Calmodulin kinase et kinase C) viennent faciliter le travail des récepteurs NON-NMDA en aidant à la conservation d'un voltage transmembranaire permettant de garder les récepteurs NMDA ouverts. De cette façon, l'instabilité électrique des membranes des neurones centraux nociceptifs s'en trouve accentuée "de façon excessive" et l'hyperirritabilité est ainsi créée.
Mais il y a pire encore. Lorsque l'usine métabolique fonctionne à plein régime et que l'effet facilitateur est acquis au niveau post-synaptique, les neurones centraux se mettent à produire de façon effrénée du monoxyde d'azote (NO) ce qui aura pour conséquences d'augmenter des nombreuses réactions biochimiques. Le NO agit à l'intérieur même du corps cellulaire où il a été produit mais il est aussi libéré à l'extérieur du corps cellulaire des neurones nociceptifs centraux où il vient agir "à rebours" sur les terminaisons pré-synaptiques et les cellules gliales. Cette substance gazeuse agit alors un peu comme un NT mais "avec effet rétrograde". Lorsque le NO se trouve en présence des différentes substances et structures sur lesquels il agit, il active une intense cascade métabolique. Les substances et structures sur lesquels le NO exerce ses effets mobilisateurs sont nombreuses et témoignent de l'ubiquité de cette substance. Ainsi, le NO provoque
-
une activation accrue de la cyclo-oxygenase intra-neuronale autant au niveau du corps cellulaire de la cellule centrale qu'au niveau du bouton pré-synaptique ce qui a pour effet d'entraîner une augmentation de la production de PG intra-neuronale,
-
une modification de certains gènes dans le noyau de même que l'expression de ceux-ci,
-
une activation très marquée de l'activité de la Guanine cyclase-S,
- une augmentation aussi très marquée de l'activité des Ez et des structures dépendant du c-GMP à la fois dans le corps cellulaire, le bouton pré-synaptique et à la fois dans la cellule gliale.
En fait, un des effets très importants du NO dans les trois structures soient le corps cellulaire des neurones centraux, les boutons pré-synaptiques et les cellules gliales s'exerce par une augmentation marquée de l'activité de la Guanylyl cyclase-S menant à un accroissement proportionnel de formation de c-GMP. La cascade biochimique se poursuivant, ce seront les Ez et les structures dépendant du c-GMP qui seront ensuite activés dans les trois structures soient le corps cellulaire des neurones centraux, les boutons pré-synaptiques et les cellules gliales. Dans le bouton pré-synaptique, cette activation mènera à l'augmentation de la production et de la libération de GLU, sP et d'au moins un autre NT nociceptif soit le CGRP et donc à une plus grande accentuation de la neurotransmission nociceptive donc à plus de douleur.
Les conséquences à l'intérieur du bouton pré-synaptique sont d'accentuer, de prolonger et pire encore de maintenir la libération accrue de glutamate. Or, l'hyperlibération de glutamate est responsable de l'hyperactivation des membranes post-synaptiques. En langage imagé, un processus infernal vient de prendre place. Le cercle vicieux est ainsi "bouclé" parce que l'hyperactivité du neurone central concourt à l'hyperactivité du bouton pré-synaptique qui est aussi "fouetté" dans ses fonctions par les cellules gliales présentes dans l'environnement immédiat des boutons pré-synaptiques et qui sont elles aussi soumises à une hyperactivation par le NO; le tout accentue encore plus l'hyperactivité du neurone central qui accentue encore plus l'hyperactivité du bouton pré-synaptique qui ... et la spirale inflationniste s'enfonce de plus en plus.
L'activation des récepteurs NMDA se fait surtout par les stimulations nociceptives en provenance des fibres C mais les récepteurs NMDA peuvent aussi répondre aux stimulations en provenance des autres fibres en autant bien sûr que celles-ci libèrent du glutamate comme NT. En fait, une large proportion des fibres sensitives périphériques A bêta et A delta possèdent la capacité d'émettre du "glutamate" et de "l'aspartate" comme NT en situation d'"hyperactivité". En situation d'hyperstimulation nociceptive les stimulations non-nociceptives, génératrices de glutamate, peuvent alors concourir au processus de neurotransmission nociceptive puisque leurs contributions deviennent alors suffisantes pour déclencher des douleurs.
Un grand nombre de neurones intermédiaires (interneurones et cellules pédonculées (Stalk Cells) au niveau de la corne postérieure peuvent aussi libérer du glutamate parmi leurs NTs. Leur contribution ne peut être commentée plus en détail actuellement.
73 - Le "maintien" d'une hyperactivation des dendrites centraux: le phénomène de "wind-up" et l'hyperalgésie "centrale"
L'activation progressive des neurones centraux à la suite de stimulations intenses et soutenues par les fibres C porte le nom de phénomène de "wind-up". Seules les fibres C peuvent provoquer le wind-up. Ce phénomène de "wind-up" des neurones nociceptifs centraux devenus de plus en plus "facilement irritables" est en fait un phénomène d'amplification de la réponse par rapport au stimuli. Ce phénomène peut prendre des proportions telles qu'une activité "spontanée" peut devenir observable dans ces neurones. On pourrait alors avancer que les NMDA, "d'amplificateur" des messages nociceptifs périphériques qu'ils étaient sont devenus des "pacemaker" des neurones nociceptifs centraux. (Voir LES LESIONS NERVEUSES: LES DIFFERENTES ANOMALIES PATHOPHYSIOLOGIQUES). En laboratoire, le phénomène de "wind-up" commence déjà à se produire à la suite de stimulations douloureuses répétées dans un même site avec une fréquence dépassant 2-3 stimuli par secondes pendant quelques heures. La définition "laboratoire" du wind-up Le wind-up se définit en laboratoire comme une augmentation progressive dans le nombre de décharges évoquées par un seul et unique stimulus en réponse à des stimulations répétées des fibres C.
En clinique, lorsque l'hypersensibilité post-synaptique aura pris toute sa dimension au point où les neurones centraux seront devenus comme des équivalents de "pacemakers nociceptifs", les douleurs seront souvent qualifiées de réfractaires et seront telles que les personnes qui les éprouveront exprimeront leur désarroi et leur souffrance par ce court énoncé trop souvent entendu.
"Ne me touchez pas, cela me fait trop mal, tout me fait mal!".
De douleurs intenses, les douleurs seront alors devenues des douleurs intenses "perpétuelles". Malheureux phénomène que ce "wind-up". Etrange adaptation que celle de provoquer une douleur hyperintense et hyperintolérable lorsque la douleur de base possède déjà tous ces caractères!
Cette étrange adaptation, c'est l'hyperalgésie "centrale" qui est ainsi créée.
On peut alors comprendre en partie pourquoi et comment l'intensité des douleurs ressenties ne semble pas toujours en concordance avec les mécanismes que l'on croit responsables de l'intensité du ou des stimuli douloureux. Les personnes "qui ont mal" depuis longtemps deviennent ainsi de moins en moins crédibles. Il faudrait peut-être encore rappeler ici que "La douleur est toujours subjective; elle est ce que le malade affirme et non ce que les autres croient qu'elle devrait être." (Voir LE PRINCIPE DES PRINCIPES).
Les explications actuelles ont porté sur les récepteurs NMDA au niveau de la corne postérieure, il convient de souligner que des récepteurs NMDA existent aux étages supérieures du cerveau. Il en existe par exemple dans certains noyaux du thalamus.
74 - Hyperexcitation et hyperexcitabilité des récepteurs NMDA: les changements anatomiques qui en résultent au niveau de la corne postérieure
L'hyperexcitation biochimique (glutamate) et électrique (voltage-dépendant) des récepteurs NMDA et l'hyperexcitabilité qui en découle vont entraîner des changements anatomiques au niveau des neurones où ces événements se produisent. Ces changements anatomiques découlent en bonne partie de l'intense activité biochimique qui se déroule à l'intérieur des neurones centraux.
Dans un premier temps, des changements sont observables au niveau des récepteurs opiacés. Ces changements se caractérisent par
- une altération de la configuration tridimensionnelle des récepteurs opiacés,
- une internalisation des récepteurs opiacés dans la membrane neuronale,
- un découplage entre la protéine G et le récepteur opiacé membranaire.
Pas étonnant alors que les opiacés offrent moins de soulagement, leurs récepteurs sont devenus moins fonctionnels. Ils sont soumis au mutisme!!! L'activation des NMDA entraîne donc une réduction de la réponse des récepteurs opiacés.
Dans un deuxième temps, ces changements se caractérisent par
- de l'oedème au niveau du corps cellulaire du neurone central,
-
des dépôts brunâtres dans les régions témoins de l'hyperactivité
et - une réduction du volume de ces mêmes neurones subissant l'hyperactivité.
Ces changements du deuxième temps sont les reflets des dommages à long terme pour les neurones concernés, dommages qui vont souvent aboutir à une "mort neuronale".
Dans les deux cas, on réfère à ces changements en terme "d'excitotoxicité".
Ces changements s'observent à deux niveaux,
-
dans la portion spinale i.e. intra-médullaire des neurones périphériques
et - chez les interneurones.
La présence de ces changements est lourde de conséquence, elle marque alors la réduction de la capacité d'inhiber le transfert des influx nociceptifs dans la corne postérieure. C'est à partir d'ici que "l'éveil" de ces récepteurs est porteur de conséquences majeures pour "les personnes qui ont mal".
Il semble qu'un point tournant ait été atteint à partir du moment où l'hyperexcitabilité a été initiée et maintenue pendant suffisamment longtemps. En effet, comme il a été proposé prédécemment, tout concourt à ce que cette hyperexcitabilité puisse se maintenir "en permanence" et "de façon autonome" par le simple apport de quelques influx nociceptifs "réguliers" sur une base relativement continue. Un autre drame découle de ce point tournant car à partir de ce moment, les approches pharmacologiques régulièrement utilisées pour le soulagement de la douleur ne peuvent apporter que très peu de résultats et cela est autant vrai pour ce qui est des co-analgésiques que des analgésiques opiacés
D'autres substances sont nécessaires et elles existent: les antagonistes NMDA.
75 - Les antagonistes NMDA comme thérapeutique possible
Plusieurs raisons militent actuellement, sur une base théorique, en faveur d'antagoniser les récepteurs NMDA pour le soulagement des douleurs neurogènes (et des douleurs chroniques):
-
le fait d'antagoniser les NMDA permet d'abolir le phénomène de "wind-up" alors que les opiacés à eux seuls ne réussissent qu'à le ralentir,
-
le fait d'antagoniser les récepteurs NMDA permet de rétablir une partie de l'effet analgésique des opiacés car en "ramenant au silence" une partie des récepteurs NMDA, les récepteurs opiacés peuvent recommencer à répondre à la médication administrée. Bloquer les NMDA élimine donc une partie des effets "anti-analgésiques" résultant de leur stimulation,
- la combinaison d'antagonistes de NMDA et d'opiacés entraîne un effet analgésique synergique et permet d'administrer les deux substances à plus faible dose puisque des effets bénéfiques sont produits à la fois par la stimulation des récepteurs opioïdes (pré et post-synaptiques) et à la fois par le blocage des récepteurs NMDA au niveau des membranes post-synaptiques. (Voir: HYPEREXCITATION ET HYPEREXCITABILITE DES RECEPTEURS NMDA: LES CHANGEMENTS ANATOMIQUES QUI EN RESULTENT AU NIVEAU DE LA CORNE POSTERIEURE)
Pour le moment, trois substances commercialement disponibles sont reconnues pour contribuer à réduire les douleurs découlant de la chaîne d'événements produite par l'activation des NMDA (hyperactivation, hyperexcitabilité, hyperalgésie centrale):
- la kétamine
-
le dextrométorphan
et - la méthadone
-
La kétamine semble apporter d'assez bons résultats analgésiques et des résultats encore meilleurs lorsque combinée aux opiacés.
-
Il a été démontré que la kétamine, par voie épidurale, est efficace pour réduire les douleurs neurogènes. Logique en fait, puisque dans les douleurs neurogènes, les dendrites nociceptifs centraux au niveau de la corne postérieure continuent d'être bombardés sans cesse par des influx originant des régions lésées, ce qui entraîne l'activation et le maintien de l'activation des récepteurs NMDA.
-
La kétamine, bien qu'utilisées dans certains milieux, n'est pas encore passée à l'usage courant. Les nombreux effets secondaires, particulièrement les symptômes psychiques tels de la confusion, des cauchemars "éveillés", de l'agitation psychomotrice, des hallucinations désagréables, des distorsions de la réalité génératrices de réactions de panique en limitent particulièrement l'usage.
-
Quant au dextrométorphan, son usage apporte plus de déception que de bénéfice.
-
La méthadone est en voie de devenir la substance désirée pour le traitement des douleurs où l'activation NMDA est suspectée être en cause. Pour le moment, la méthadone est le seul médicament connu jouant le double rôle recherché soit d'être en même temps un opiacé et un bloqueur NMDA.
-
-
-
En laboratoire, la phencyclidine et le MK-101 sont aussi des bloqueurs des NMDA. Par ailleurs, toujours en laboratoire, l'administration d'AINS par voie épidurale ou intra-thécale empêche l'hyperalgésie "centrale" découlant du phénomène de wind-up de se produire, cet effet est dû à l'inhibition des cyclo-oxygénases intra-neuronales et non pas à l'inhibition des NMDA.Les AINS n'ont malheureusement pas cet effet lorsqu'administrés par voie systémique ou encore, si l'effet se produit, il est insuffisant pour entrainer une réduction de ces mécanismes et donc des douleurs qui en découlent.
76 - Hyperexcitation et hyperexcitabilité des récepteurs NMDA: les provenances possibles dans un contexte de soins palliatifs oncologiques
Mais d'où peut provenir cette accentuation continue d'influx nociceptifs ?
Dans un contexte de soins palliatifs oncologiques, elle peut provenir des sources multiples. Un surplus d'influx nociceptifs peut ainsi trouver origine à partir:
-
de certaines régions dans le tissu nerveux (nerf, plexus, racine) qui subissent ou ont subi des agressions découlant d'un processus tumoral ou d'un traitement relié au cancer et qui présentent alors une nette augmentation de l'instabilité électrique dans ces régions,
-
de certaines régions des réseaux cutanés, musculo-squelettiques ou viscéraux qui subissent des dommages tissulaires découlant d'un processus tumoral ou d'un traitement relié au cancer et qui deviennent alors le lieu d'une hyperstimulation des nocicepteurs,
- d'une zone d'ischémie tissulaire provoquée directement par un processus tumoral faisant obstacle à la vascularisation ou indirectement par un état d'hypercoagulabilité (thrombophlébite et embolies artérielles).
Toutes ces situations peuvent concourir à activer les NMDA. Et comme si cette activation n'était pas suffisante en soi, une telle hyperstimulion nociceptive entraîne souvent une participation du système nerveux autonome sympathique qui entrant en jeu à son tour provoque une hypersensibilisation des nocicepteurs de la région où de la douleur est ressentie ce qui ouvre la porte à un cercle vicieux indésirable puisque le tout vient rehausser considérablement l'intensité des douleurs. (Voir: LE SYSTEME "SYMPATHIQUE" ... QU'IL NE FALLAIT PAS OUBLIER!).
77 - Éparpillement multi-étage, multi-convergence, douleur irradiée et douleur référée
Que le contexte clinique soit celui d'une douleur "sans" activation des récepteurs NMDA ou que le contexte clinique soit celui d'une douleur "avec" activation des récepteurs NMDA, les notions qui suivent et cela jusqu'à la fin du présent chapître s'appliquent toujours
Il a été fait mention, plus avant, de l'éparpillement multi-étagé des fibres nociceptives au niveau de la corne postérieure, éparpillement particulièrement marqué pour les fibres nociceptives d'origine viscérale, et de la multi-convergence. Il a été suggéré que l'éparpillement multi-étagé et la multi-convergence permettaient de mieux comprendre la douleur "référée".
Cependant en clinique, deux situations se rencontrent fréquemment: la douleur "référée" et la douleur "irradiée". Douleur "référée" et douleur "irradiée" sont deux réalités différentes.
La douleur "irradiée" décrit la zone d'un dermatome où est ressentie une douleur quand un nerf est soumis à un stimulus nociceptif quelconque, souvent une compression. Ainsi, la douleur ressentie au "gros orteil" en raison d'une hernie discale L5 en est un exemple. Il est bien entendu qu'à partir du moment où le multi-étagement de l'éparpillement augmente comme cela est susceptible de se rencontrer en situation d'ouverture des NMDA et de contribution du système nerveux autonome sympathique, la zone où est ressenti la douleur irradiée s'élargit tout autant.
La douleur "référée" pour sa part est celle qui est ressentie dans la zone d'un
-
dermatome
ou -
myotome
ou -
sclérotome
ou - viscérotome
alors qu'il n'existe pas de stimulations nociceptives dans le dermatome ou myotome ou sclérotome ou viscérotome où la douleur est ressentie.
La nomenclature dermatome ou myotome ou sclérotome ou viscérotome provient de l'époque embryologique et se rattache au développement de l'embryon autour du 26e jour. L'origine embryologique des afférences et les liens de ces afférences avec leur segment médullaire aussi appelé métamère remonte à cette époque.
Chaque étage ou segment médullaire (pex.: C5, D11, L4) reçoit des afférences des 4 entités trouvant origine au niveau embryologique: la peau, les muscles, les structures osseuses / cartilagineuses et les viscères. Le segment médullaire innervant telle région ou structure s'appelle un métamère.
Les structures cutanées possèdent des métamères ou segments médullaires habituellement assez bien définis, ainsi il est assez facile d'attribuer un segment médullaire pour les surfaces cutanées et ce segment cutanée est généralement assez clairement délimité sans chevauchement avec une autre surface cutanée. Cette surface cutanée rattachée à un segment médullaire particulier correspond aux dermatomes auxquels on fait référence si souvent.
En regard de la surface cutanée, il est même possible d'explorer la notion de dermatome plus en détail. Ainsi chaque neurone nociceptif est connecté à une portion anatomique spécifique de la surface cutanée, cette portion s'appelle "le champ récepteur". Chaque champ récepteur constitue une toute petite portion d'un dermatome, un dermatome étant la surface cutanée dont l'innervation est associée de façon préférentielle à une racine particulière (ou nerf spinal). Chaque champ récepteur recouvre une partie d'un autre champ récepteur lui aussi nociceptif. Il existe ainsi une importante superposition de champs récepteurs pour toute surface donnée. Par ailleurs, à l'exemple des champs récepteurs nociceptifs, chaque type de perception sensorielle posséde ses propres champs récepteurs ce qui amène finalement un important chevauchement de différents champs récepteurs appartenant chacun à des afférences sensorielles différentes.
Par ailleurs, les structures autres que les surfaces cutanées possèdent elles-aussi des métamères ou segments médullaires mais qui sont habituellement un peu moins bien définis voire beaucoup moins bien définis. Les mieux définis après les dermatomes sont les myotomes et il demeure encore est assez facile de reconnaître un segment médullaire pour les différents groupes musculaires mais déjà l'étalement est plus grand et un peu moins précis que pour les dermatomes. A titre d'exemple, un problème à l'étage L5-S1 peut entraÎner une ténomyalgie au niveau des muscles fessiers, ischio-jambiers et des muscles du mollet (triceps sural: gastrocnemius et soleus). Cet exemple illustre le fait qu'un site rachidien puisse donner différentes zones de douleurs référées à la fois dans un dermatome et à la fois dans un myotome qui ne se chevauchent pas l'une et l'autre et qui pourtant originent du même métamère à l'étape embryologique.
Ensuite viennent les associations métamères - structures osseuses / cartilagineuses, ce qui correspond aux sclérotomes. Ici, les distances commencent à prendre plus d'importance et les associations entre les structures osseuses / cartilagineuses et les métamères dont ces structures originent sont parfois déroutantes de prime abord. L'exemple classique à cet égard concerne l'atteinte des articulations interapophysaires de la charnière dorso-lombaire soit D11-D12-L1 et la région fessière et/ou sacro-iliaque et/ou crête iliaque postérieure où la douleur peut être ressentie, parfois en surface, parfois en profondeur. Un autre exemple classique concerne le diaphragme et l'épaule dont l'innervation au stage embryologique origine pour chacune de ces structures des segments C3-C5. Dans le cas du diaphragme, les afférences pour mieux suivre le diaphragme ont empruntées le nerf phrénique pour faire leur migration vers le bas de sortes qu'elles se sont éloignées considérablement de leurs segments d'origine. Ainsi, une atteinte du diaphragme peut donner des douleurs référées dans le sclérotome C3-C5.
Enfin, les viscérotomes sont les plus éparpillés et ceux offrant les limites les moins précises en raison du fait que les viscères envoient leurs afférences non seulement vers plusieurs segments ou racines à la fois (étalement sur au moins quatre à six racines) mais vers des segments médullaires qui sont souvent très loin de leur localisation, ceci parce que durant l'embryogénèse, la migration de certaines structures s'est faite sur de longues distances. Ainsi, des structures aussi diverses que le tiers distal de l'oesophage, l'estomac, le grêle, le caecum, l'appendice, le colon ascendant et transverse, le foie, la vésicule biliaire, les canaux biliaires, le pancréas et les surrénales peuvent envoyer des afférences nociceptives qui transitent, sans faire de synapses (car il s'agit des fibres périphériques!) par le plexus coeliaque et ensuite le grand nerf splanchnique avant d'atteindre les métamères D6-D9 et possiblement jusqu'à D5-D10. Un exemple classique de douleur référée impliquant deux viscérotomes concerne l'appendice et l'ombilic. Il arrive souvent qu'une douleur d'appendicite soit d'abord ressentie dans la région de l'ombilic, cela parce que le segment métamérique recevant les afférences de ces deux structures est le même, soit D10. Ce n'est qu'au momemt où les nocicepteurs du péritoine pariétal qui appartiennent pour leur part au réseau somatique que la douleur commence à être véritablement perçue comme provenant de l'appendice.
En regard des douleurs référées, il peut arriver que la douleur soit ressentie en deux régions, celle où la stimulation nociceptive s'exerce véritablement et dans le dermatome ou myotome ou sclérotome ou viscérotome concerné comme il peut arriver que la douleur ne soit ressentie que dans le dermatome ou myotome ou sclérotome ou viscérotome concerné alors que la stimulation nociceptive se déroule ailleurs.
L'erreur d'interprétation par le cerveau se fait sur le site où les mécanismes nociceptifs se produisent car le cerveau avise alors qu'il se produit une stimulation nociceptive mais dans une "fausse région", la zone "référée". Le cerveau confond alors site douloureux et siège des mécanismes nociceptifs qui dans la cas des douleurs référées sont deux sites différents. Ainsi, la douleur ressentie dans le bras gauche lors d'une crise d'angine ou lors d'un infarctus en est un exemple puisqu'à ce moment, ni les nocicepteurs du bras gauche, ni les nerfs périphériques ni les racines contenant les afférences du bras gauche ne sont soumis à une stimulation nociceptive.
Deux hypothèses ont cours actuellement pour tenter d'expliquer les douleurs référées:
-
une convergence entre les afférences nociceptives vraies et les nociceptives nociceptives "non stimulées" sur les mêmes neurones centraux qui fait en sorte que la région où la douleur "référée" est ressentie correspond alors à la zone médullaire où se font les plus importantes "arrivées simultanées" entre
- les fibres afférentes nociceptives provenant de la structure viscérale, ostéoarticulaire ou nerveuse lésée i.e. là où la stimulation douloureuse se produit
-
- les afférences nociceptives de la région "donnée" i.e. de la zone où la douleur est ressentie
L'influx nociceptif provenant de la structure lésée est intégré au niveau du cerveau comme provenant du territoire non lésé: il y a erreur sur la localisation de la lésion. Le cerveau n'est pas capable de faire la différence entre les deux sites en raison de la convergence des informations au niveau de la moelle.
- une double direction de l'influx nociceptif arrivant au neurone central soumis à la multi-convergence de sorte qu'une portion des influx subirait un revers de direction et pourrait être véhiculée de façon antidromique dans les afférences nociceptives non stimulée. Un tel influx antidromique pourrait favoriser la libération antidromique de substance P qui entraînerait à son tour la libération d'autres substances algogènes au niveau de la zone référées i.e. au niveau de la zone non stimulée.
Dans un cas comme dans l'autre, le cerveau à tendance à préférablement projeter la douleur référée sur une structure somatique. Mais l'inverse peut très bien se rencontrer à savoir une origine somatique alors que la douleur est ressentie au niveau viscéral.
Comprise de cette façon, la douleur référée peut alors s'étendre sur des zones plus ou moins larges. En référence aux éparpillements "céphalad" et "caudad" que peuvent prendre les fibres nociceptives du faisceau de Lissauer à leur entrée dans la moelle, il est possible d'en déduire certains éléments "cliniques". A cet effet, moins les afférences nociceptives en provenance d'un dermatome, d'un myotome ou d'un sclérotome sont éparpillées, plus la zone de douleur référée sera réduite et précise. Le contraire est aussi vrai. Il faut dire par ailleurs que cet éparpillement connaît des différences anatomiques individuelles d'une personne à l'autre.
Par ailleurs, il faut rappeler que "l'arrivée simultanée" des afférences de la région lésée et celles de la région référée ne concerne pas uniquement que deux fibres telle qu'on pourrait l'imaginer dans une vision simplifiée de la convergence. En fait cette "arrivée simultanée" touche
-
l'arrivée d'une fibre nociceptive périphérique sur plusieurs dendrites appartenant à plusieurs neurones nociceptifs ascendants, cette fibre transportant déjà plusieurs champs récepteur,
-
l'arrivée de plusieurs fibres nociceptives périphériques sur plusieurs dendrites appartenant à plusieurs neurones nociceptifs ascendants, chaque fibre transportant donc une multitude de champs récepteur d'où l'élargissement de la zone où est ressentie la douleur référée, enfin en présence d'une activation des NMDA et d'une participation du système sympathique, cette arrivée simultanée touche aussi
- l'arrivée de plusieurs fibres périphériques non-nociceptives sur un même neurone nociceptif central ascendant et transportant encore chacune leurs propres champs récepteurs mais venant ajouter dans les circonstances un net rehaussement du transfert nociceptif. (Voir LE SYSTEME DE TRANSPORT DES INFLUX NOCICEPTIFS: LA PORTION CENTRALE)
Il est bien entendu que les événements décrits ci-haut s'appliquent tout autant au niveau du tronc cérébral où le noyau spinal du trijumeau se trouve l'équivalent de la corne postérieure pour recevoir les afférences nociceptives de la face (Voir: LE SYSTEME DE TRANSPORT DES INFLUX NOCICEPTIFS: LA PORTION CENTRALE).
En somme, face à ces phénomènes de multi-étagement et de multi-convergence, une conclusion s'impose de toute évidence:
- à chaque fois qu'un neurone nociceptif est suffisamment lésé, il risque de se produire un élargissement des champs récepteurs. Plus cet élargissement s'étend, plus les zones où la douleur référée se manifeste se trouvent "déformées" par rapport à l'anatomie courante des dermatomes.
-
-
Ces transformations sont susceptibles d'ajouter encore d'autres difficultés à la personne qui a mal car en raison de l'élargissement des champs récepteurs et du dépassement des champs récepteurs habituels, l'anatomie normale de la douleur risque de ne plus se retrouver entraînant souvent un doute dans l'esprit des soignants.
-
-
Enfin, il faut aussi souligner que "l'arrivée simultanée" des afférences nociceptives de la région lésée ne concerne pas uniquement que les neurones centraux nociceptifs. En fait cette "arrivée simultanée" concerne aussi les neurones moteurs et donc
-
- l'arrivée de fibres nociceptives périphériques sur plusieurs dendrites appartenant à plusieurs neurones moteurs, ce qui amène de fait un certain tonus contractil chez plusieurs fibres musculaires en même temps.
-
-
Pour la musculature du tronc et des membres, les neurones moteurs impliqués dans ces interconnexions sont localisés dans la corne antérieure de la moelle, pour la musculature du cou et de la tête ils sont situés dans les noyaux moteurs des nerfs crâniens. Il est donc possible d'observer des contractions musculaires réflexes suite à des stimulations nociceptives soutenues.
78 - Un exemple clinique de la multi-convergence
De nombreuses situations cliniques pourraient venir illustrer ces changements. L'envahissement du plexus brachial par une néoplasie au sommet pulmonaire ou par des adénopathies axillaires d'une néoplasie du sein servira d'exemple. Ces deux situations cliniques peuvent entraîner des douleurs intenses, de divers types et en divers endroits du membre supérieur.
La mise en situation suivante en offre différents aspects:
-
en certains endroits du membre supérieur atteint, des douleurs peuvent être présentes de façon constante sans provocation quelconque
-
les zones douloureuses de ces douleurs peuvent respecter certains dermatomes, mais rapidement dans l'évolution, les douleurs "déborderont" des limites anatomiques habituelles
-
les zones douloureuses de ces douleurs peuvent respecter certains dermatomes, mais rapidement dans l'évolution, les douleurs "déborderont" des limites anatomiques habituelles
-
en d'autres endroits, le moindre stimulus externe provoque la survenue de douleurs intenses parfois descriptibles, mais bien souvent indescriptibles
-
les douleurs ainsi déclenchées peuvent demeurer limitées aux régions "géographiquement logiques" où le stimulus a été appliqué mais bien souvent c'est tout l'ensemble du membre supérieur qui subit des secousses douloureuses violentes, encore ici, les douleurs "débordent" des limites anatomiques habituelles.
-
les douleurs ainsi déclenchées peuvent demeurer limitées aux régions "géographiquement logiques" où le stimulus a été appliqué mais bien souvent c'est tout l'ensemble du membre supérieur qui subit des secousses douloureuses violentes, encore ici, les douleurs "débordent" des limites anatomiques habituelles.
Aucune des situations cliniques ainsi décrites n'est une vue de l'esprit. "L'architecture ordonnée" des ces différentes présentations, en apparence "illogiques", se trouve pourtant bien présente au niveau de la corne postérieure où existe l'équivalent de l'homonculus cortical avec toutes les représentations anatomiques disposées dans une logique parfaite. (Voir: LE TERMINUS PERIPHERIQUE ET LE PREMIER RELAIS CENTRAL: LA CORNE POSTERIEURE ET SA CONSTITUTION EN COUCHES)
Comment comprendre que de telles présentations cliniques puisse se produire?
En fait, la multi-convergence avec ses arrivées simultanées d'influx nociceptifs provenant autant de fibres nociceptives que non-nociceptives offre la base architecturale pour une partie de la compréhension applicable à de telles situations cliniques. L'hyperexcitabilité dispersée sur plusieurs étages, au niveau de la corne postérieure, devient tellement importante que le moindre stimulus provoque alors une dépolarisation massive d'un grand nombre de dendrites centraux nociceptifs, tellement importante même que des douleurs paroxystiques originant des neurones centraux peuvent apparaître au grand déplaisir de la personne qui les ressent. La multi-convergence amène un bombardement massif des neurones centraux, il ne faut pas l'oublier.
Mais il peut finalement arriver que le moindre type de stimulus provoque, de façon stéréotypée, des douleurs souvent indescriptibles dans une toute autre région du membre supérieur que la région stimulée. C'est alors le phénomène d'allodynie qui n'est absolument pas l'équivalent d'une douleur référée.
Et à ce moment, il demeure difficile, avec la seule notion de multi-convergence, de comprendre qu'un stimulus appliqué dans une région donnée du membre supérieur puisse déclencher des douleurs dans d'autres régions du même membre, aussi bien adjacentes qu'éloignées. Cette notion semble insuffisante pour expliquer une telle situation. Les conséquences ou les répercussions de la multi-convergence dans un contexte d'hyperactivité nociceptive y sont pour beaucoup dans la génèse de telles situations cliniques. Mais il y a plus. Une autre partie des explications peut provenir des échanges "éphaptiques".
D'autres conséquences tels des connexions "erronées" entre divers types de fibres sensorielles dans les régions où se déroulent les agressions neuronales fournissent une autre part d'explications. A cet effet, il faut rappeler que les neurones dans un nerf sont organisés en faisceaux. En présence d'agression tumorale (ou autre agression suffisamment sévère), certains neurones "échangent" des influx avec d'autres types de neurones. Il devient alors possible que l'influx produit par un simple effleurement dans une région donnée soit "échangé" avec une fibre nociceptive dans la région où se produit l'agression nerveuse. Cet échange "non-synaptique" entre deux axones s'appelle une communication éphaptique. On peut facilement imaginer que plus l'agression est importante dans une région donnée, plus les phénomènes "éphaptiques" puissent être nombreux et plus l'allodynie devienne incommodante.
79 - La multi-convergence anarchique et les échanges éphaptiques
La multi-convergence ne peut expliquer à elle-seule les phénomènes d'allodynie. Les échanges éphaptiques pourraient en expliquer une partie.
Les régions soumises à des agressions neuronales tumorales ou tout autre type suffisamment sévère peuvent présenter des situations s'apparentant à des "court-circuits" entre des fibres axonales voisines. De telles connexions "erronées" entre divers types de fibres sensorielles dans les régions où se déroulent les agressions neuronales peuvent alors fournir une autre part d'explications.
A cet effet, il faut rappeler que les neurones dans un nerf sont organisés en faisceaux. En présence d'agression tumorale (ou autre agression suffisamment sévère), certains neurones "échangent" des influx avec d'autres types de neurones. Il devient alors possible que l'influx produit par un simple effleurement dans une région donnée soit "échangé" avec une fibre nociceptive dans la région où se produit l'agression nerveuse. Cet échange "non-synaptique" entre deux axones s'appelle une communication éphaptique. On peut facilement imaginer que plus l'agression est importante dans une région donnée, plus les phénomènes "éphaptiques" puissent être nombreux et plus l'allodynie devienne incommodante.
80 - La multi-convergence et ses répercussions: la douleur référée dans un dermatome
La multi-convergence peut se répercuter de différentes manières en clinique. Ainsi, la douleur
- peut être référée dans une portion ou dans la totalité d'un dermatome
- peut déclencher une réponse motrice réflexe "efférente"
- peut en même temps déclencher une réponse sympathique "réflexe".
Lorsque la douleur est référée dans un dermatome, elle peut être ressentie
- dans la totalité d'un dermatome. C'est la situation où tout se présente "comme cela devrait être", i.e. que l'anatomie "normale" est respectée.
Cependant, cette douleur peut aussi être ressentie
- uniquement dans une portion d'un dermatome,
et plus confondant encore,
- sur une surface recoupant plus d'un dermatome.
Chacune de ces deux situations confondantes viennent ajouter une difficulté dans l'évaluation de la douleur parce que la présentation usuelle des douleurs "irradiées" nous a habitué, le plus souvent, à retrouver l'entièreté d'un dermatome impliqué. Or dans le cas des douleurs "référées", ce n'est souvent pas la situation.
81 - La multi-convergence et ses répercussions: le déclenchement d'une réponse motrice réflexe "efferente"
La douleur peut déclencher une réponse motrice réflexe "efférente" dans un ou plusieurs muscles squelettiques en raison de l'arrivée de fibres nociceptives périphériques sur plusieurs dendrites appartenant à plusieurs neurones moteurs. Cette réponse motrice réflexe "efférente" se manifeste par une augmentation du tonus musculaire pouvant aller jusqu'à des contractions spastiques qui peuvent à leur tour devenir douloureuses.
La douleur "aiguë" peut déclencher une réponse motrice réflexe de deux ordres:
- une réponse reflexe tellement vive qu'elle se manifeste par un geste de retrait,
- une contraction musculaire soutenue comme on observe souvent dans les présentations de cervicalgie ou de lombalgie alors que les douleurs aigues s'accompagnent d'une contraction de certains groupes musculaires paravertébraux.
La douleur "chronique" entraîne pour sa part des réponses motrices réflexes d'un autre ordre dont les conséquences deviennent parfois "harassantes". C'est le cas, par exemple, des douleurs cervicales musculo-squelettiques qui apparaissent suite aux laryngectomies.
Quand la structure musculaire où se produisent des réponses motrices réflexes est accolé à des structures scléreuses
- plèvre pariétale,
- péritoine pariétal,
- gaine synoviale,
il peut arriver que l'hypertonicité musculaire soutenue puisse aller jusqu'à entraîner une certaine irritation de la scléreuse avoisinante et produire ainsi l'équivalent d'une activation inflammatoire par effet loco-régional. Les zones où sont alors ressenties les douleurs deviennent plus étendues et souvent encore plus vagues. L'évaluation s'en trouve de nouveau plus complexe.
82 - La multi-convergence et ses répercussions:le déclenchement d'une réponse sympathique réflexe hyperactive
La douleur peut déclencher une réponse sympathique "réflexe" hyperactive puisque les terminaisons médullaires de fibres nociceptives périphériques peuvent aussi faire synapse, au niveau de la corne postérieure, avec des fibres sympathiques préganglionnaires, soit directement soit indirectement par le biais d'interneurones.
Ce transfert synaptique entre des "afférences nociceptives" et des "efférences sympathiques" produit une accentuation de l'activité du système sympathique qui peut même conduire à une hyperactivité adrénergique en périphérie puisqu'alors les influx sympathiques sont augmentés.
Or, il existe des nocicepteurs non seulement au niveau du derme mais il en existe aussi au niveau de la paroi des vaisseaux et ces nocicepteurs sont munis de récepteurs adrénergiques de type alpha-1. Ces récepteurs adrénergiques de type alpha-1 sont du même type que ceux faisant partie de la paroi des vaisseaux sanguins pour le contrôle de la tonicité des muscles lisses (vasoconstriction / vasodilatation). L'hyperactivité sympathique est donc susceptible de produire plusieurs effets néfastes en périphérie puisqu'elle stimulera à la fois les nocicepteurs cutanés et capillaires et à la fois la vasoconstriction des vaisseaux concernés.
Il est donc possible de retrouver des douleurs compliquées d'une participation du système nerveux autonome sympathique ou "sympathetically maintained pain". C'est ce qui s'observe dans le cas de la dystrophie réflexe sympathique.
L'hyperactivité adrénergique avec ses effets sur les récepteurs "alpha-1" est susceptible d'entraîner de lourdes conséquences à plusieurs niveaux:
-
AU NIVEAU DU DERME, l'hyperactivité sympathique peut se répercuter
-
sur les nocicepteurs cutanés qui peuvent alors subir une sensibilisation en raison de la présence accrue de norépinéphrine. Cette sensibilisation a pour effet d'abaisser le seuil d'activation et donc d'accentuer la sensibilité des nocicepteurs aux stimulations douloureuses et aux substances chimiques algogènes présentes. (Voir plus haut "LE SYSTEME "SYMPATHIQUE" QU'IL NE FALLAIT PAS OUBLIER ..."),
-
sur les nocicepteurs des vaisseaux sanguins qui sont reconnus pour réagir particulièrement à la présence accrue de norépinéphrine, de bradykinine et de 5-hydroxy-tryptamine (sérotonine). Cette importante sensibilisation a pour effet d'accentuer la sensibilité des nocicepteurs aux stimulations douloureuses et aux substances chimiques algogènes présentes. (Voir plus haut "LE SYSTEME "SYMPATHIQUE" QU'IL NE FALLAIT PAS OUBLIER ..."),
- sur la paroi des vaisseaux qui connaissent alors une vasoconstriction entraînant de l'hypoxie responsable à son tour de production de prostaglandines, histamine, bradykinine, sérotonine en plus des substances découlant directement du métabolisme anaérobique tel l'acide lactique. Ces substances exercent finalement un effet sensibilisateur sur les nocicepteurs sensibles aux stimuli "chimiques" et la cascade sensibilisation - activation entre en jeu
-
sur les nocicepteurs cutanés qui peuvent alors subir une sensibilisation en raison de la présence accrue de norépinéphrine. Cette sensibilisation a pour effet d'abaisser le seuil d'activation et donc d'accentuer la sensibilité des nocicepteurs aux stimulations douloureuses et aux substances chimiques algogènes présentes. (Voir plus haut "LE SYSTEME "SYMPATHIQUE" QU'IL NE FALLAIT PAS OUBLIER ..."),
Il n'est donc pas surprenant d'assister alors aux phénomènes
-
-
d'hyperalgésie, définie comme "une réponse augmentée à un stimulus douloureux" car la sensibilisation des nocicepteurs sur une zone élargie fait en sorte qu'une douleur extrêmement sévère peut résulter d'une stimulation nociceptive de faible intensité,
- aux phénomènes d'allodynie définie comme "une douleur résultant d'un stimulus qui ne provoque habituellement pas de douleur" car la présence de nombreuses substances algogènes amène non seulement les nocicepteurs mais aussi les autres types de récepteurs à réagir et même à hyperréagir à tout type de stimulus autre que douloureux. Or les neurones centraux particulièrement de la couche V, les WDR, ont comme particularité de recevoir toutes les sortes d'afférences possibles (ils sont multiconvergents). C'est donc dire combien ils sont activés dans ces circonstances par des stimulations aussi simples que le fait de toucher superficiellement une région cutanée et cette stimulation provoque alors de la douleur.
-
d'hyperalgésie, définie comme "une réponse augmentée à un stimulus douloureux" car la sensibilisation des nocicepteurs sur une zone élargie fait en sorte qu'une douleur extrêmement sévère peut résulter d'une stimulation nociceptive de faible intensité,
-
AU NIVEAU VISCERAL, l'hyperactivité sympathique peut se répercuter
-
sur les sphincters pour entraîner des dystonies sphinctériennes pouvant aller jusqu'à des spasmes francs. Ces dysfonctions sphinctériennes peuvent alors être ressenties comme des inconforts surajoutés aux douleurs viscérales déjà présentes,
-
sur la paroi des vaisseaux qui connaissent alors une vasoconstriction entraînant de l'hypoxie viscérale responsable à son tour de la production de prostaglandines, histamine, bradykinine, sérotonine en plus des substances découlant directement du métabolisme anaérobique tel l'acide lactique. Ces substances exercent finalement un effet sensibilisateur sur les nocicepteurs sensibles aux stimuli "chimiques" (les viscères sont composés presque exclusivement de nocicepteurs polymodaux) et la cascade sensibilisation - activation entre en jeu avec d'autres substances ischémiques et inflammatoires qui s'ajoutent. En même temps, le phénomène d'activation secondaire prend de l'ampleur avec l'élargissement de la zone où "la soupe inflammatoire" est déversée ce qui a pour effet de provoquer de la douleur "surajoutée" soit en intensité ou en surface. Il est important de noter que les douleurs viscérales sont toujours mal définies surtout en terme de localisation et de surface. (Voir: L'ACTIVATION SECONDAIRE" / LA DOULEUR NOCICEPTIVE VISCERALE: SON ORIGINE PATHOPHYSIOLOGIQUaE / LA DOULEUR NOCICEPTIVE VISCERALE: SON CARACTERE CLINIQUE),
-
sur les nocicepteurs qui peuvent alors subir une sensibilisation en raison de la présence accrue de norépinéphrine sans compter l'ajout d'autres substances ischémiques et inflammatoires qui s'ajoutent tel que discuté dans les lignes précédentes. Cette sensibilisation a pour effet d'accentuer encore plus la sensibilité des nocicepteurs aux stimulations douloureuses et aux substances chimiques algogènes déjà présentes. (Voir plus haut "LE SYSTEME "SYMPATHIQUE" QU'IL NE FALLAIT PAS OUBLIER ...").
-
sur les sphincters pour entraîner des dystonies sphinctériennes pouvant aller jusqu'à des spasmes francs. Ces dysfonctions sphinctériennes peuvent alors être ressenties comme des inconforts surajoutés aux douleurs viscérales déjà présentes,
Le déclenchement d'une réponse sympathique réflexe hyperactive par des influx nociceptifs est donc susceptible d'entraîner, dans certaines conditions, la création d'un circuit s'autogénérant. L'hyperactivation des nocicepteurs de tous les types engendrant une augmentation des afférences nociceptives au niveau de la corne postérieure, cette augmentation des afférences nociceptives amplifiant les échanges synaptiques au niveau de la corne postérieure avec des fibres sympathiques préganglionnaires. Plus il se trouve de fibres sympathiques activées, plus les conséquences périphériques sont grandes au niveau des différents récepteurs. Plus les récepteurs de tous types sont activés, plus il arrive d'afférences nociceptives au niveau de la corne postérieure et ainsi de suite.
Le cercle vicieux ainsi créé offre de fait une partie des explications pour des douleurs que l'on qualifiait autrefois de "dystrophie sympathique réflexe / algodystrophie / causalgie et encore bien d'autres" et qui selon la nomenclature de l'IASP sont de nos jours qualifiées de "Sympathetically Maintained Pain" i.e. des douleurs dont la présence soutenue est sous la gouverne du système nerveux autonome sympathique.
83 - Le blocage des réponses sympathiques réflexes et le possible bénéfice d'un tel blocage
Quand le cercle vicieux des douleurs entretenues par l'hyperactivité du système sympathique est ainsi "déclenché", il est souvent difficile de contrôler adéquatement ces douleurs. La panoplie d'approches suggérées dans le cas des douleurs avec participation du système sympathique en témoigne.
Ce qui pourrait apparaÎtre comme logique à savoir le blocage des récepteurs adrénergiques alpha-1 par des médicaments systémiques afin de réduire les stimulations nociceptives provoquées par l'hypersécrétion nonadrénergique sur les nocicepteurs périphériques et même un blocage de la chaîne ganglionnaire sympathique impliquée par une technique anesthésique ne parviennent souvent pas à offrir l'analgésie espérée.
Les douleurs avec participation du système nerveux sympathique offrent tout un défi à la thérapeutique analgésique.
84 - Le système de transport des influx nociceptifs: la portion centrale d'origine médullaire
A partir de la zone synaptique où des millions d'axones "périphériques nociceptifs" ont fait des synapses de toutes sortes avec le deuxième ensemble de neurones, les neurones nociceptifs "centraux" et donc les influx nociceptifs continuent alors leur ascension vers les régions supérieures, c'est-à-dire le tronc cérébral et le cerveau.
Avant de commencer vraiment cette ascension, la majorité des axones centraux traversent la moelle d'un bord à l'autre i.e. ils décussent. Après avoir ainsi "décussé", ces axones se positionnent alors dans la région antéro-latérale de la moelle où ils commencent vraiment leur ascension. Cependant, peut-être jusqu'à 25 % pourraient faire leur ascension du même côté que leur point d'entrée. En se dirigeant vers le côté opposé, ces axones centraux se regroupent proche à proche dans différents sous-ensembles formant chacun un faisceau ou tractus particulier dans lesquels ils vont faire leur ascension vers différents points d'arrivée dans le cerveau.
Il existe au moins quatre différents trajets ou tractus nociceptifs qui méritent d'être signalés et par lesquels l'information "douleur" fait son ascension, dans la moelle, vers le cerveau
- le tractus spinothalamique, le plus important de tous les tractus nociceptifs et souvent le seul auquel on se réfère. Cet important tractus se subdivise en deux portions: une très vieille, la portion paléo-spinothalamique et une plus récente, la portion néo-spinothalamique.
-
Le néo-spinothalamique transporte les influx nociceptifs et les influx du toucher léger cependant il transporte en prédominance ( 80%) des influx nociceptifs. Il fait ascension directement vers le thalamus sans envoyer d'embranchements (collatérales) durant son ascension, on le dit monosynaptique. A partir de la région supérieure de la protubérance, le néo-spinothalamique s'associe au paléo-spino-thalamique et les deux font bon voisinage avec le lemniscus médian.
-
-
A l'étage cervicale, le néo-spinothalamique connaît deux divisions, la classique monosynaptique controlatérale et une autre qui fait ascension vers le thalamus dans un faisceau ipsilatéral, le faisceau spino-cervico-thalamique. Les fibres de ce faisceau font une première synapse dans la corne postérieure au niveau des couches III, IV et V (Voir: LE TERMINUS PERIPHERIQUE ET LE PREMIER RELAIS CENTRAL: LA CORNE POSTERIEURE). Elles montent alors toujours du même côté où elles ont fait synapses dans la moelle et arrivent ainsi dans la partie supérieure de la moelle, à l'étage de C1 où elles font de nouveau synapses dans le noyau cervico-latéral (NCL). Après synapse dans le NCL, les fibres centrales décussent alors et font leur ascension vers le thalamus en joignant le néo-spinothalamique controlatéral d'où le dernier relais central se fera avant d'arriver dans le cortex pariétal. La fonction de ce faisceau est principalement de véhiculer les informations du toucher léger superficiel.
-
- Le paléo-spinothalamique pour sa part transporte presqu'exclusivement des influx nociceptifs. Il émet de nombreux embranchements (collatérales) tout au long de son ascension dans le bulbe, la protubérance, le mésencéphale et dans le diencéphale, on le dit polysynaptique, si bien qu'à l'étage du mésencéphale, le paléo-spinothalamique a perdu beaucoup de sa taille. A partir de la région supérieure de la protubérance, le paléo-spinothalamique s'associe au néo-spino-thalamique et les deux font bon voisinage avec le lemniscus médian.
-
Ces trois derniers faisceaux sont souvent considérés comme des sous-faisceaux du faisceau paléo-spino-thalamique.
-
Les autres faisceaux comprennent les faisceaux
- spino-réticulaires (portion médullaire antéro-latérale - arrivée à l'étage bulbaire dans la formation réticulée: noyau giganto-cellulaire et réticulaire latéral), qui est le deuxième plus important faisceau de transmission nociceptive chez les humains
- spino-mésencéphaliques ou spino-ponto-mésencéphaliques (portion médullaire antéro-latérale - arrivée à l'étage mésencéphalique dans la région de la substance grise périaqueducale et l'aire para-brachiale)
- spino-solitaires.
Une portion des fibres nociceptives fait aussi son ascension au travers
-
des cordons postérieurs (dorsal column) dont la fonction principale concerne le transport des sensations tactiles complexes (proprioception consciente i.e. la discrimination tactile [discrimination deux points], le sens de la position, le sens de vibration et la kinesthésie).
Les influx nociceptifs qui font "transit" par les cordons postérieurs montent du même côté où ils sont entrés dans la moelle sans faire de synapse à la corne postérieure. Ils arrivent ainsi dans le tronc cérébral, au niveau bulbaire, et font alors synapses dans les noyaux gracilis et cuneatus ipsilatéraux. Les fibres centrales décussent alors et font leur ascension dans le faisceau lemniscus médian vers le thalamus d'où le dernier relais synaptique se fera avant d'arriver dans le cortex pariétal.
-
du faisceau spino-cervico-thalamique faisant partie du système cervical latéral et dont la fonction est principalement de véhiculer les informations de toucher léger superficiel.
Les différents influx sensitifs et nociceptifs qui font "transit" par le faisceau spino-cervico-thalamique font synapses dans la corne postérieure au niveau des couches III, IV et V (Voir: LE TERMINUS PERIPHERIQUE ET LE PREMIER RELAIS CENTRAL: LA CORNE POSTERIEURE). Ils montent alors du même côté où ils sont entrés et ont fait synapses dans la moelle. Ils arrivent ainsi dans la partie supérieure de la moelle, à C1, et font de nouveau synapses dans le noyau cervical latéral. Les fibres centrales décussent alors et font leur ascension vers le thalamus en joignant le lemniscus médian d'où le dernier relais central se fera avant d'arriver dans le cortex pariétal.
De multiples régions du cerveau reçoivent ainsi des influx nociceptifs. À partir de ces différentes régions, l'information "nociceptive" est relayée vers des ensembles structuraux complexes impliqués dans l'intégration, l'interprétation, la gestion et la mémoire de l'information "douleur" avec les répercussions sur le plan moteur, affectif et comportemental que cela implique. Pour ce qui est des régions corticales et sous-corticales, cette circuiterie pourrait se résumer en quatre grandes fonctions: réception (cortex pariétal primaire (S1)), intégration et interprétation (cortex pariétal secondaire (S2) et aires gnosiques), émotion et mémorisation (système limbique), comportement (système limbique). (Voir: LES COMPOSANTES NON-PHYSIQUES: LEUR SUBSTRAT ANATOMO-PHYSIOLOGIQUE).
85 - Le système de transport des influx nociceptifs: la portion centrale originant du noyau spinal du trijumeau
Pour ce qui concerne les afférences nociceptives en provenance de la face (peau, structures osseuses, articulations temporo-mandibulaires), des muqueuses nasales, sinusales et buccales, de la partie antérieure de la langue, de la dentition, de la cornée et de la portion crânienne osseuse antérieure, elles font leur entrée dans le tronc cérébral par le nerf V à l'étage de la protubérance. Ces afférences périphériques forment un long faisceau descendant dans le tronc cérébral, c'est le "faisceau" spinal du trijumeau. Immédiatement accolé à ce faisceau descendant, se trouve, un peu plus en médial, le "noyau" spinal du trijumeau (l'équivalent de la substance grise de la corne postérieure) où les afférences nociceptives périphériques du V se terminent. Ce noyau s'étend lui aussi en longueur dans les trois étages mésencéphale-protubérance-bulbe du tronc et il s'étend même jusqu'à la partie supérieure de la moelle cervicale puisqu'il s'arrête au troisième ou quatrième segment cervical où il se confond avec la substance gélatineuse. C'est donc dire que les fibres du faisceau spinal du trijumeau descendent elles-même aussi bas que le segment cervical C4 où elles fusionnent avec les couches I-IV de la corne postérieure.Ce noyau reçoit aussi des afférences des VIIe, IXe et Xe nerf crânien. L'étendue de ce noyau est vaste, son multiétagement est parfois divisé en trois sections, la portion supérieure correspondant au noyau "oralis", la portion intermédiaire au noyau "interpolaris" et la portion la plus inférieure au noyau "caudalis ou subcaudalis". Le fibres du faisceau spinal provenant de la portion mandibulaire du V arrivent au noyau "oralis" alors que les fibres de la région ophtalmique arrivent au noyau "caudalis ou subcaudalis". Il arrive ainsi que des lésions cervicales supérieures puissent parfois déclencher de la douleur dans la branche ophtalmique du V ou parfois une absence de la perception douloureuse en raison de cette particularité anatomique. Enfin, ce noyau possède des interconnexions avec le noyau moteur du V situé au niveau de la protubérance, ce qui explique les contractions réflexes des mâchoires en présence de stimulations douloureuses intenses.
Tout comme au niveau de la corne postérieure, les fibres nociceptives se terminent donc du même côté où elles ont pénétré, c'est donc dire que la terminaison des fibres nociceptives du trijumeau est elle aussi ipsilatérale.
A partir de la zone synaptique les neurones centraux originant du noyau spinal du trijumeau décussent à leur tour, avant de commencer vraiment leur ascension. Après avoir ainsi "décussé", ces axones font leur ascension regroupés proche à proche dans le faisceau trigémino-thalamique ventral (équivalent du faisceau spino-thalamique) qui se confond à partir de l'étage supérieur du mésencéphale avec le lemniscus médian. Ce faisceau projette ses terminaisons vers la formation réticulée et vers la portion ventro-postérieure des noyaux thalamiques médians (noyau ventro-postéro-médians (VPM)) et vers les noyaux intra-laminaires tout comme les faisceaux paléo-spinothalamiques l'avaient fait. A leur tour ces noyaux envoient leurs projections vers le cortex pariétal somesthésique.
De multiples régions du cerveau reçoivent ainsi des influx nociceptifs en provenance de la face et de la partie antérieure du crâne. À partir de ces différentes régions, l'information "nociceptive" est relayée vers des ensembles structuraux complexes impliqués dans l'intégration, l'interprétation, la gestion et la mémoire de l'information "douleur" avec les répercussions sur le plan moteur, affectif, comportemental que cela implique. (Voir: LES COMPOSANTES NON-PHYSIQUES: LEUR SUBSTRAT ANATOMO-PHYSIOLOGIQUE).
86 - Le point d'arrivée des influx nociceptifs: les étages supérieurs "mode sensoriel" et "mode affectif"
Le nom que portent l'ensemble des faisceaux ascendants décrit leur point d'origine et leur point d'arrivée. Il n'y a pas de faisceaux qui font ascension directement vers le cortex. Tous les faisceaux font un ou des relais par une ou par plusieurs structures sous-corticales avant d'envoyer finalement leurs projections vers les régions corticales. Ainsi, des influx nociceptifs peuvent arriver au niveau des structures suivantes:
- la formation réticulée particulièrement dans la région du noyau giganto-cellulaire "nucleus reticularis gigantocellularis", du noyau réticulaire latéral et du locus coeruleus,
- la substance grise périaqueducale (SGPA) - dans le mésencéphale,
- l'hypothalamus,
- le thalamus - dans plusieurs noyaux différents,
- le système limbique particulièrement l'amygdale et le cortex cingulaire.
Durant l'ascension des influx nociceptifs par les différents faisceaux ascendants, certaines structures reçoivent une large part d'afférences soit directement i.e. que les fibres se terminent dans ces structures, soit par des projections axonales (aussi appelées collatérales) pour les fibres qui continuent alors leur ascension vers d'autres structures.
Presque toutes les structures ayant reçu des afférences de la part des faisceaux ascendants envoient à leur tour des afférences vers d'autres structures situées à la fois aux étages plus haut (rostrales) et à la fois aux étages plus bas (caudales).
La formation réticulée est soumise en plusieurs de ses noyaux à une profusion d'informations nociceptives.
-
Le noyau réticulaire giganto-cellulaire (nucleus reticularis gigantocellularis) et le noyau réticulaire latéral reçoivent des afférences du faisceau spino-réticulaire (ou paléo-spino-réticulo-thalamique) d'origine à la fois ipsi et controlatérale. Après avoir reçu ces afférences, ils envoient à leur tour des projections vers la substance grise périaqueducale (SGPA) et le thalamus (particulièrement le noyau centro-médian (NCM)).
- Le locus coeruleus est une structure nucléaire complexe à dominance noradrénergique mais aussi une portion cholinergique située à la jonction ponto-mésencéphalique du plancher du IVe ventricule. Il est impliqué dans les mécanismes de contrôle de l'éveil cortical, de vigilance, d'éveil et de sommeil. Le locus coeruleus joue aussi un rôle important dans les réponses à des stress (pex. une lésion du locus supprime la tachycardie lié à un stress menaçant), dans la régulation des hormones liées au stress de même que dans les comportements d'alerte et de fuite. Il est à l'origine du système limbique noradrénergique. Plus les stimulations nociceptives sont importantes, plus l'activité du locus augmente.
Une fois activés par la voie paléo-spino-réticulaire, les cellules du locus envoient des projections ascendantes vers les noyaux intralaminaires du thalamus puis le cortex cingulaire (système limbique), le cortex frontal et le cortex insulaire. Le locus envoie aussi des projections vers les noyaux paraventriculaires de l'hypothalamus (rôle dans le contrôle de la posthypophyse), vers l'amygdale (système limbique) et vers le néocortex cérébral (éveil cortical et attention accompagnant le processus d'alerte. Le faisceau paléo-spino-réticulo-thalamique ne renseigne donc pas sur la localisation, l'intensité en terme d'échelle de douleur, la surface et la durée comme le faisceau néo-spino-thalamique le fait mais il renseigne plutôt sur l'intensité du désagrément du stimulus douloureux, c'est-à-dire la composante émotionnelle "pure". Finalement, par ses projections hypothalamiques, le relais "locus coeruleus" est aussi responsable des réactions autonomiques (ou végétatives).
- La SGPA et l'aire para-brachiale sont pour leur part de très importants terminaux du faisceau spino-mésencéphalique qui est une composante du faisceau paléo-spino-thalamique. La substance grise périaqueducale (SGPA) est un ensemble de cellules enveloppant l'aqueduc de Sylvius à la hauteur du mésencéphale. Un grand nombre de substances jouent un rôle au niveau de la biochimie de la SGPA (noradrénaline, sérotonine, glutamate ... ). Par ailleurs, la majorité des cellules de la SGPA sont stimulées par les opiacés. La SGPA envoie des projections descendantes vers la moelle et des projections tronculaires vers le locus cruleus et le noyau raphé magnus (dominance sérotoninergique) et joue de cette façon un rôle important dans le contrôle inhibiteur descendant lors de la neurotransmission nociceptive à l'étage médullaire.
Le thalamus représente probablement le plus important relais pour ce qui est des influx nociceptifs. Plusieurs de ses noyaux sont impliqués dans des activités de relais nociceptif. Ce n'est vraiment qu'à partir du thalamus que la douleur est perçue à un niveau conscient, avant elle n'est qu'un influx nociceptif qui parcoure différents circuits à l'insu de tout niveau perceptuel. Cependant, bien que la douleur commence à être perçue à un niveau conscient à l'étage thalamique cette perception demeure encore frustre. La douleur ne "révélera" tous ses états qu'après avoir passé par les différents cortex somato-sensoriels et limbiques.
Les faisceaux spinothalamiques et les nombreux sous-faisceaux originant des différents relais par lesquels les influx nociceptifs ont passé se terminent principalement dans 5 régions thalamiques:
- noyau ventro-postéro-latéral (VPL)
- noyau du complexe nucléaire postérieur (PO)
- noyaux parafasciculaires
- certains noyaux intra-laminaires
- noyaux dorso-médians (DM) et centro-médians (CM).
Mais ce sont les noyaux ventro-latéraux et ventraux-médians qui sont les plus importants relais.
L'importance de certains de ces noyaux est illustrée par le syndrome thalamique. La zone la plus souvent impliquée dans les syndromes thalamiques est le Noyau Ventral-Postérieur (VP) également appelé Complexe Ventro-Basal (VB). Dans ce complexe, les sous-entités Noyau Ventro-Postéro-Latéral (VPL) et Ventro-Postéro-Médian (VPM) sont le plus souvent touchées par des lésions d'ACV ischémiques. La destruction des ces deux noyaux provoque une hémianesthésie et quelques temps plus tard des douleurs centrales hémicorporelles. Le travail de filtration des différentes afférences sensorielles ne se fait plus de sorte que des stimulations sensorielles des plus banales peuvent provoquer des douleurs d'une intensité absolument indescriptible.
-
le noyau ventro-latéral postérieur (VLP) et les noyaux du complexe nucléaire postérieur (PO) reçoivent les afférences du faisceau néo-spino-thalamique, donc des informations nociceptives précises telles:
- la localisation des stimuli douloureux
- l'intensité
- la surface
- la durée.
Ces noyaux envoient ces informations par un troisième ensemble de projections vers le cortex somesthésique pariétal primaire (SI) où se retrouve l'homonculus qui est en fait une représentation somatotopique précise des différentes parties du corps. Le cortex somesthésique pariétal primaire (SI) reçoit toujours des informations controlatérales. En contre-partie, ces noyaux thalamiques (VLP et PO) reçoivent des afférences des régions corticales S1, afférences cortico-thalamiques dont la fonction sera d'exercer un rôle modulateur inhibiteur afin de réduire la réception et la transmission des informations nociceptives arrivant au niveau thalamique. Il se fait donc une modulation des influx nociceptifs à des niveaux très élevé.
De plus, le cortex pariétal primaire (S1) envoit à son tour des projections vers le cortex pariétal somesthésique secondaire postérieur (S2), situé au niveau de l'opercule temporal, où se trouvent les aires associatives. Tout comme dans la relation thalamus-cortex pariétal primaire (S1), le cortex pariétal secondaire renvoit à son tour des projections vers le cortex paritétal primaire, donc des afférences cortico (S2)-corticales (S1).
Certaines portions des noyaux thalamiques latéraux envoient une abondance de projections vers le cortex préfrontal (moteur) et la cervelet ce qui suggère que ce noyau participe à des activités motrices consécutives aux stimulations nociceptives.
Enfin, les noyaux thalamiques latéraux envoient aussi une portion des informations directement au cortex pariétal somesthésique secondaire (S2) postérieur. A ce niveau cependant, la somatotopie est beaucoup moins bien organisée qu'en S1 et les afférences proviennent de projections ipsi et controlatérales.
-
les noyaux parafasciculaires, dorso-médians (NDM) et centro-médians (NCM) du complexe médian de même que certains noyaux intra-laminaires reçoivent les afférences du faisceau paléo-spino-thalamique. Dans la plupart des cas ces afférences ont d'abord fait relais dans différentes structures du tronc cérébral. Ces divers noyaux thalamiques envoient à leur tour des projections diffuses vers
-
les structures du système limbique (amygdale) responsable de la mémorisation des expériences douloureuses (stockage des informations) et des comportements d'alarme liés à la douleur (fuite, désinhibition ...)
-
l'hypothalamus responsable des composantes autonomiques liées à la douleur (réponse surrénalienne sécrétrice d'épinéphrine, tachycardie, respiration accélérée)
- les structures corticales associatives (cortex cingulaire et autres) responsables de la composante affective désagréable de la douleur.
-
les structures du système limbique (amygdale) responsable de la mémorisation des expériences douloureuses (stockage des informations) et des comportements d'alarme liés à la douleur (fuite, désinhibition ...)
Pour ce qui est du système limbique et du cortex cingulaire, ces deux structures modulent, probablement de façon prépondérante, le caractère affectif ou émotionnel des douleurs ressenties, ces deux structures ajoutent en fait le caractère "désagrément" des douleurs. Durant les années 1950, des lobotomies frontales, pratiquée chez des personnes présentant des douleurs extrêmement sévères, ont démontré qu'il était possible, en coupant les circuits du système limbique, du cortex frontal et cingulaire, de réduire la composante "émotive" des douleurs i.e. le caractère "désagrément" bien que ces personnes aient pu continuer à ressentir la même intensité de douleur, sans le caractère désagréable cette fois-ci.
- certains noyaux du thalamus reçoivent des affférences à la fois du néo et à la fois du paléo-spino-thalamique.
L'aboutissement final de nombreuses projections nociceptives corticales se fait au niveau de différents cortex ayant des fonctions diverses. Ainsi, des projections arrivent notamment vers:
- le cortex pariétal somesthésique primaire (S1) (somatotopie précise représentée par l'homonculus et origine contro-latérale),
- le cortex pariétal somesthésique secondaire (S2) situé au niveau de l'opercule temporal (somatotopie moins précise sans homonculus et origine bilatérale),
- le cortex fronto-orbitaire (représentation bilatérale),
- le cortex frontal (aire 9, 10, 46, 47 de BROADMAN recevant des informations paléo-spino-thalamiques),
- le cortex cingulaire antérieur,
- le cortex limbique (noyau central de l'amygale recevant des informations essentiellement d'origine mésencéphalique).
Dans leur ascension vers le cortex pariétal somesthésique primaire du gyrus post-central (S1) et vers l'operculum pariétal (cortex pariétal somesthésique secondaire) situé immédiatement postérieur au gyrus post-central (S2), les projections thalamiques nociceptives tout comme les autres projections sensorielles passent par la portion postérieure de la capsule interne et par la "corona radiata". D'autres projections font ascension vers le cortex frontal.
Les projections d'origine viscérale pour leur part sont dirigées vers le cortex insulaire, enfoui en profondeur dans la fissure latérale. Le cortex insulaire échange des projections avec le système nerveux autonome. Une activation du cortex insulaire produit des nausées et des vomissements ce qui s'observe souvent en présence de douleurs viscérales importantes.
L'arrivée des projections thalamiques nociceptives provenant des différents noyaux thalamiques impliqués se fait selon une distribution très spécifique dans certaines aires corticales et dans certaines couches corticales. Ainsi, les projections nociceptives thalamiques arrivent dans la quatrième couche des cellules corticales du gyrus post-central, du lobule paracentral et de l'operculum pariétal. A partir de cette couche, les influx nociceptifs sont alors relayés vers les couches plus superficielles pour permettre une plus grande intégration des messages nociceptifs. Enfin les influx sont dirigées vers les couches les plus superficielles pour l'intégration finale (caractère, localisation, intensité, durée). Or ce sont les couches les plus superficielles qui sont les plus vulnérables à certaines conditions (carcinomatose, atteinte vasculaire) et c'est ce qu'on observe dans le syndrome pariétal alors que les couches les plus superficielles ne peuvent plus accomplir leur rôle d'intégration finale en raison d'un ACV.
En plus d'avoir envoyé des projections cortico-thalamiques servant à moduler le transfert d'influx nociceptifs au niveau thalamique, les différentes régions du lobe pariétal impliquées dans la réception et l'intégration des informations nociceptives projettent aussi des faisceaux d'association vers le cortex frontal, les structures limbiques et les noyaux hypothalamiques impliqués dans les relais nociceptifs. Les faisceaux d'association les plus impliqués dans les relais nociceptifs sont le faisceau fronto-occipital supérieur et le faisceau longitudinal supérieur. Les faisceaux d'associations sont de longs faisceaux qui jouent un rôle très important dans l'élaboration d'activités uniformisées dans le système nerveux central ce qui explique en bonne partie l'ensemble des réactions observées autant en contexte de douleurs aiguës importantes qu'en contexte de douleurs chroniques handicapantes. Lorsque ces faisceaux sont lésés, le patient peut continuer de percevoir la douleur mais la composante émotive et comportementale est perdu. C'est ce qui était observé quand des lobotomies frontales étaient pratiquées dans les années 1950.
En résumé, les dimensions sensorielles et émotives sont toujours reçues et traitées de façon synchrone par les différentes structures centrales concernées par la douleur:
-
pour la composante sensorielle, le faisceau néo-spino-thalamique projette vers le thalamus latéral qui projette vers le cortex pariétal primaire qui à son tour projette vers le cortex paritéal secondaire et des faisceaux de rétroaction partent du secondaire vers le primaire et du primaire vers le thalamus latéral.
- pour la composante émotive, le faisceau paléo-spino-thalamique avec ses sous faisceaux spino-réticulaire, spino-mésencéphalique et spino-solitaire projette vers le thalamus médian en même temps que vers les structures du système limbique.
87 - Hyperexcitation et hyperexcitabilité: les conséquences "électrophysiologiques" sur les structures centrales nociceptives
En présence d'hyperstimulation nociceptive en provenance de fibres périphériques (douleurs nociceptives intenses ou douleurs neurogènes intenses), il devient possible d'observer des changements "électrophysiologiques" de plusieurs ordres,
-
non seulement au niveau de la corne postérieure, mais aussi à plusieurs autres niveaux en direction ascendante notamment. Ces changements peuvent ainsi être observés dans: (MZ 214 D P3)
- les faisceaux ascendants nociceptifs (spinothalamiques et autres) où des activités ectopiques "spontanées" avec fréquences anormalement élevées apparaissent
- le thalamus où s'observent des décharges spontanées paroxystiques avec fréquences anormalement élevées
- le cortex sensitif.
Ces changements "électrophysiologiques" peuvent s'exprimer de diverses manières:
- des influx commencent à se propager dans les neurones centraux avec une fréquence anormalement élevée, souvent sous forme de longues traînées d'influx qui conservent la régularité
- des salves de décharges paroxystiques spontanées de durée variable s'entremêlent à ces traînées d'influx anormalement élevée en fréquence.
Plus les lésions sont sévères et importantes, plus ces anomalies prennent de l'importance car les phénomènes "d'hyperexcitation et d'hyperexcitabilité" jouent un rôle de plus en plus marqué.
88 - Lésions périphériques: les "différents degrés" de désafférentation
Les lésions subies par les fibres nociceptives le sont sous différents degrés de sévérité. L'aboutissement ultime de ces lésions peut conduire à un sectionnement complet d'un certain nombre de neurones nociceptifs, ce qui mène à une désafférentation.
Chaque sectionnement neuronal mène à une désafférentation spécifique de ce neurone. Lorsque plusieurs neurones sont sectionnés dans un nerf, ce nerf devient alors "partiellement désafférenté". Ce n'est que lorsque tous les neurones nociceptifs composant un nerf en particulier ont été sectionnés qu'on peut alors parler de "désafférentation complète". La douleur devient sévère bien avant la désafférentation complète!!!
89 - La douleur neurogène ...sur tout le réseau ascendant!
Beaucoup d'attention a été jusqu'à maintenant portée au réseau nociceptif. Il a été proposé lors de l'introduction du résumé anatomo-physiologique "simplifié" et "vulgarisé" que l'activité électrique neuronale nociceptive transportant l'information "douleur" peut trouver son origine à partir de deux sources. La première source, soit l'activation des nocicepteurs a été abondamment décrite.
La deuxième source d'influx nociceptifs, cette fois responsable de la douleur neurogène, découle non pas d'une activation des nocicepteurs mais de la production d'influx électrique (potentiel d'action) découlant de dépolarisations focales de la membrane neuronale d'une fibre nociceptive dans une ou des région(s) où la fibre nociceptive subit ou a subi une agression.
La douleur neurogène peut trouver son origine autant
-
dans une fibre périphérique
que - dans une fibre centrale.
Cette deuxième composante s'avère d'une importance considérable dans le contexte des soins palliatifs "oncologiques". Elle est aussi à la source de plusieurs douleurs chroniques. Les lésions produites sur les fibres nociceptives entraînent l'apparition de salves spontanées d'influx nociceptifs. Les études démontrent par ailleurs que plus les lésions sont proches du système nerveux central, plus la durée des décharges spontanées se prolonge dans le temps. Il n'y a alors qu'un pas à franchir pour concevoir qu'un certain nombre de douleurs post-traumatiques et/ou post-chirurgicales puissent trouver là une part de leur explication. A titre d'exemple, les douleurs post-extraction dentaires, post-thoracotomie, post-trauma du plexus brachial.
90 - La contrepartie des faisceaux ascendants: les faisceaux descendants inhibiteurs
Peu importe l'origine nociceptive ou neurogène des douleurs, les différents faisceaux ascendants autres que le faisceau néo-spinothalamique (qui lui est mono-synaptique jusqu'au thalamus) fournissent des informations "NOCICEPTIVES" dans de nombreuses zones tronculaires et sous-corticales impliquées dans la gestion et l'intégration des informations nociceptives. (Voir: LE POINT D'ARRIVEE DES INFLUX NOCICEPTIFS: LES ETAGES SUPERIEURS "MODE SENSORIEL" ET "MODE AFFECTIF")
Ces nombreuses zones de relais et de réception envoient à leur tour des projections descendantes vers différentes structures spécifiques situées toujours plus bas à partir desquelles partiront d'autres projections descendantes transportant des influx qui auront comme fonction d'inhiber la transmission des douleurs entre les fibres périphériques et centrales au niveau de la corne postérieure. Ces zones deviennent donc de fait des sources multicentriques d'influx inhibiteurs descendants. Ainsi, des projections inhibitrices descendantes prendront origine à partir des différentes structures suivantes:
- cortex frontal et pariétal
- système limbique - particulièrement l'amygdale, le cortex cingulaire, le cortex insulaire,
- thalamus - plusieurs noyaux différents
- hypothalamus - quelques noyaux,
-
formation réticulée
- région mésencéphalique: la substance grise péri-aqueducale (SGPA) et l'aire para-brachiale,
- région de la jonction ponto-mésencéphalique: le locus coeruleus, la partie supérieure de la substance grise péri-aqueducale (SGPA) et de l'aire para-brachiale,
- région de la protubérance (pont): le noyau subcoeruleus (portion A7) à la portion supérieur de la protubérance et la continuation des noyaux du raphé bulbaire,
- région bulbaire: le raphé magnus (raphe médian et para-médian), le noyau giganto-cellulaire "nucleus reticularis gigantocellularis", para-giganto-cellulaire et le noyau réticulaire latéral.
-
Ces différentes structures émettront à leur tour des fibres descendantes de deux ordres: On les qualifie de sérotoninergiques et de noradrénergiques.
-
de longues fibres qui descendent directement vers les cornes postérieures de tous les étages médullaires,
-
de courtes fibres d'interconnexions (projections) qui font relais dans leur descente vers d'autres structures un peu plus basses (caudales) situées au niveau
-
du mésencéphale
- substance grise périaqueducale
-
de la protubérance (pons)
- noyau coeruleus (nucleus coeruleus) (jonction mésencéphalo-protubérantielle) et noyau subcoeruleus (portion A7) à la partie supérieure de la protubérance
- noyau raphé magnus (nucleus raphe magnus) (le noyau raphé magnus est un long noyau qui s'étend au niveau de la protubérance et du bulbe)
-
du mésencéphale
-
-
du bulbe (medulla)
- région médiane: noyau raphé magnus composé du raphe médian et para-médian (nucleus raphe magnus), long noyau qui s'étend à l'étage de la protubérance et du bulbe,
- région au pourtour immédiat du raphé magnus surtout dorsale et/ou latérale: le noyau giganto-cellulaire "nucleus reticularis gigantocellularis", le noyau giganto-cellulaire portion alpha "nucleus reticularis gigantocellularis pars alpha [NGCpa]", le noyau para-giganto-cellulaire ou giganto-cellulaire réticulaire latéral qui tel que son nom l'indique est situé dans la portion latérale de la formation réticulée alors que tous les autres noyaux impliqués dans les relais nociceptifs sont situés à la portion centrale
- région dorsale franche: noyau réticulaire dorsal (dorsal reticularis nucleus).
-
du bulbe (medulla)
A partir de ces différentes structures appartenant à la formation réticulée répartent alors d'autres fibres descendantes vers les cornes postérieures de tous les étages médullaires.
Les fibres originant des noyaux de la formation réticulée vont jouer un rôle majeur dans la genèse des influx inhibiteurs descendants.
La Substance grise périaqueducale (SGPA) envoit une multitude de projections descendantes et ces projections se font principalement vers le complexe locus coeruleus / subcoeruleus (noyau A7) et vers les structures du Complexe bulbaire rostro-ventral médial (Rostral Ventro-medial Medulla) composé du raphé magnus (raphe médian et para-médian), du noyau giganto-cellulaire "nucleus reticularis gigantocellularis", du noyau giganto-cellulaire portion alpha "nucleus reticularis gigantocellularis pars alpha [NGCpa]" et du noyau para-giganto-cellulaire ou giganto-cellulaire réticulaire latéral.
De façon moindre, des projections sont aussi envoyées directement vers la corne postérieure à tous les étages médullaires. Pour ses projections vers le noyau raphé magnus, la SGPA utilise probablement de la neurotensine comme neurotransmetteur. La majorité des cellules de la SGPA possède une abondance de récepteurs opiacés et de tous les types à leur surface et cela autant au niveau du corps et de ses dendrites qu'au niveau des terminaisons pré-synaptiques. L'activation de la SGPA par des stimulations électriques ou par des stimulations pharmacologiques, particulièrement avec des opiacés injectés directement, produit un blocage important de la neurotransmission nociceptive au niveau de la corne postérieure, réduisant de ce fait la douleur, on parle alors d'antinociception. On peut donc en déduire que les opiacés utilisés de façon systémique vont avoir pour effet d'activer les cellules de la SGPA qui vont alors émettre des influx inhibiteurs à profusion vers la corne postérieure. Une partie de l'antinociception (du soulagement de la douleur) se joue donc aux étages supérieures où sont créés les influx inhibiteurs descendants.
Le noyau ceruleus (nucleus ou locus ceruleus) et le noyau subcoeruleus (A7), jouent aussi un rôle important dans la modulation inhibitrice du transfert des influx douloureux au niveau de la corne postérieure en participant à la création des contrôles inhibiteurs descendants par l'émission de sous-faisceaux descendants noradrénergiques arrivant au niveau du raphe magnus (étage bulbaire) ou arrivant directement dans plusieurs couches de la corne postérieure, soit les couches I, II, IV, V et X. Cette participation découle pour une part d'une stimulation directe par des influx nociceptifs provenant de sous-faisceaux nociceptifs ascendants et d'autre part de stimulations provenant de structures supérieures principalement de la SGPA mais aussi de l'hypothalamus. L'effet inhibiteur des faisceaux descendants originant des noyaux coeruleus et subcoeruleus semble plus important en post-synaptique qu'en pré-synaptique selon de nombreuses études.
Le noyau raphé magnus, le noyau giganto-cellulaire, le noyau giganto-cellulaire-alpha [NGCpa] et le noyau giganto-cellulaire réticulaire latéral jouent un rôle de relais particulièrement important à partir de la substance grise périaqueducale (SGPA) et des autres centres supérieurs dans la génèse des influx inhibiteurs descendants puisqu'une lésion au niveau du noyau raphé magnus peut interrompre l'effet inhibiteur descendant observé aux étages médullaires de la corne postérieure lorsqu'une activation de la SGPA est produite. En fait, lorsque la SGPA perd ses relais bulbaires (raphé magnus, noyau giganto-cellulaire, noyau giganto-cellulaire-alpha [NGCpa], noyau giganto-cellulaire réticulaire latéral, elle ne peut plus jouer sa fonction "antinociceptive" de façon aussi importante. Ces structures bulbaires jouent donc un rôle modulateur extrêmement important en regard de la neurotransmission nociceptive à l'étage médullaire.
Bien que ces structures jouent principalement un rôle de relais, elles peuvent aussi assumer un certain degré de modulation "antinociceptive" aux étages médullaires de la corne postérieure sans dépendance de structures supérieures telles la SGPA.
Les projections de ces noyaux utilisent principalement de la sérotonine comme neurotransmetteur. Ils envoient de préférence leurs efférences inhibitrices vers de courts interneurones pédiculés situés dans les couches I, II, III, IV, V, VI et VII de la corne postérieure qui utilisent pour leur part de l'enképhaline comme neurotransmetteur.
On constate ainsi que le tronc cérébral, de par le mésencéphale, la protubérance (pons) et le bulbe rachidien (medulla oblongata) est particulièrement impliqué dans la production d'informations modulatrices "inhibitrices".
D'autres fibres descendantes partent encore des structures suivantes:
- noyau caudé antérieur, portion du corps strié situé au dessus du thalamus (nucleus caudate anterior) -
- du noyau arqué ou arciforme (arcuate nucleus) situé dans l'hypothalamus -
-
noyau réticulaire latéral, noyau du faisceau solitaire, l'hypothalamus latéral, noyau rouge, la substance noire. Toutes ces structures participent également à l'élaboration de projections inhibitrices descendantes et sont donc capables de produire une inhibition des transferts nociceptifs au niveau des étages médullaires. Cela est particulièrement vrai pour le noyau Subnucleus Reticularis Dorsalis situé dans la formation réticulée bulbaire qui répond à tout type de stimulus nociceptif, peu importe son origine.
L'ensemble des fibres descendantes inhibitrices, originant de structures multiples (corticales, sous-corticales, mésencéphaliques, protubérantielles, bulbaires), se regroupent finalement en sous-ensembles de faisceaux descendants parmi lesquels figurent les faisceaux:
- raphé-spinal (sérotoninergique)
- réticulo-spinal (catécholaminergique)
- céruléo-spinal (catécholaminergique)
- cortico-spinal.
Ces différents faisceaux inhibiteurs descendants vont se reunir finalement dans la région dorso-latérale de la corne postérieure, où ils descendent à travers le faisceau descendant dorso-latéral (Dorso-lateral Funiculus).
La fonction de ces différents sous-faisceaux regroupés dans le faisceau descendant dorso-latéral est de moduler le transfert de l'information nociceptive particulièrement dans les régions synaptiques de la corne postérieure en faisant parfois "de l'obstruction systématique", c'est-à-dire en fermant la porte au transfert des influx "douloureux" en provenance de la périphérie, d'où le nom de Théorie du portillon (Gate Control) proposé par Melzack et Wall. Ces faisceaux inhibiteurs descendants utilisent, durant leur descente, préférentiellement deux types de neurotransmetteurs:
-
la sérotonine
et -
la norépinéphrine.
A leur arrivée dans la corne postérieure, ils vont utiliser d'autres types de NTs (Voir: LES DIFFERENTS SOUS-CIRCUITS INTERMEDIAIRES DE CONNEXION: LEURS NEUROTRANSMETTEURS).
De nombreuses circonstances permettent d'illustrer le "blocage systématique" exercé par ces faisceaux descendants, à titre d'exemple, l'absence de douleurs dans les premiers moments d'une blessure lors d'une activité sportive ou d'un accident de la route ou encore la présence bienfaisante d'une mère qui console son enfant et qui de ce fait entraine un arrêt de la douleur ...
Plusieurs des structures supraspinales énumérées ci-haut peuvent être activés dans différentes circonstances toutes autres que celles d'une stimulation nociceptive. Ainsi les activités cognitives comme tenir une conversation "agréable", les activités émotives "positives" comme écouter une musique "agréable" ont aussi pour effet par les relais du système limbique de produire des influx inhibiteurs descendants.
91 - L'effet "portillon" (Gate Control) selon Melzack et Wall et une plus nouvelle théorie: le controle inhibiteur diffus induit par la nociception (CIDN)
Une fois l'ensemble du réseau nociceptif ainsi revu, il est plus facile de comprendre la théorie du portillon et l'effet portillon telle que formulée par Melzack et Wall.
La théorie du portillon et l'effet "portillon" reposent sur l'arrivée simultanée dans la corne postérieure d'influx de trois types:
-
• nociceptifs
• sensitifs non-nociceptifs (toucher léger, proprioception, massage, TENS ...)
et
• inhibiteurs (à partir des faisceaux inhibiteurs descendants).
Grâce à la présence d'influx sensitifs non-nociceptifs et d'influx inhibiteurs descendants arrivant à la corne postérieure, il est possible de "mettre des embûches" aux transferts nociceptifs qui se font entre les fibres nociceptives périphériques et centrales au niveau de la corne postérieure. Ces "embûches" sont exercées par des mécanismes faisant inhibition à ces transferts et ces mécanismes ont été pensés et décrits par Melzack et Wall comme jouant le rôle d'un portillon qui ouvre ou ferme le passage au transfert d'influx.
Ainsi, lorsque des transferts nociceptifs se font entre les fibres nociceptives périphériques et centrales, l'effet "portillon" peut s'exercer de deux façons:
• par l'arrivée d'influx en provenance des fibres larges myélinisées (A alpha et A bêta).
Les influx originant des fibres de gros et moyen calibre A alpha et A bêta, qui transmettent à des vitesses variant de 30 - 120 m/s donc beaucoup plus rapidement que les fibres C et A delta, viennent activer une multitude d'interneurones dans certaines couches de la corne postérieure dont la fonction est de bloquer le transfert des influx nociceptifs provenant des petites fibres (A delta et C) vers les neurones centraux. Ce blocage par les interneurones se produit par une action pré-synaptique sur le bouton pré-synaptique ou par une action post-synaptique sur la membrane ou les dendrites du corps cellulaire de la cellule centrale (spino-thalamique et autres faisceaux ascendants). Cette activation d'interneurones apporte ainsi la contribution "modulatrice" des grosses fibres A alpha et A bêta. L'activation des grosses fibres par des approches non-pharmacologiques telles un massage ou du TENS (stimulation électrique à basse intensité et haute fréquence) vient supporter sur une base clinique l'idée de cette modulation.
• Les massages ont pour effet de manipuler, étirer, déformer les myofibrilles (fibres musculaires) provoquant de ce fait une activation des récepteurs situés à ces niveaux (fuseaux musculaires [muscle spindles], organes tendineux de Golgi [Golgi tendon organ], récepteurs spécialisés [tendons, ligaments et articulations]). Ces récepteurs sont connectés à des fibres A alpha qui apportent ainsi leur contribution au portillon.
• Le TENS intervient de façon plus superficielle et l'activité électrique exercée par la neurostimulation se limite habituellement au niveau cutané bien que les ajustements de voltage et d'ampérage puisse entraîner de fines contractions musculaires saccadées suivant la fréquence de décharge de l'appareil. La stimulation cutanée active les récepteurs qui sont connectés à des fibres A bêta qui apportent à leur tour leur contribution au portillon.
• par l'arrivée d'influx en provenance des faisceaux inhibiteurs descendants réunies dans le faisceau dorso-latéral (FDL) et qui ont pris origine dans les "zones modulatrices" supra-spinales principalement tronculaire (mésencéphale: substance grise périaqueducale, protubérance: noyau ceruleus (nucleus coeruleus), bulbe: noyau raphé magnus, noyau réticulaire gigantocellulaire latéral.
Les neurones des faisceaux inhibiteurs descendants arrivent principalement vers les couches (laminae) I, II et V de la corne postérieure (Voir: LE TERMINUS PERIPHERIQUE ET LE PREMIER RELAIS CENTRAL: LA CORNE POSTERIEURE). Les fibres des faisceaux dorso-latéraux vont produire leur effet de modulation (blocage des transferts nociceptifs) de deux façons: en faisant synapse directement en pré ou post-synaptique ou en activant, elles aussi, une multitude d'interneurones dont l'action sera aussi de bloquer le transfert des influx nociceptifs périphériques vers les neurones centraux de la même façon que les interneurones activés par les fibres Aa et Ab l'ont fait. La stimulation des faisceaux postérieurs (gracilis et cuneatus) par un neurostimulateur interne (à basse fréquence et haute intensité) tout comme les approches et techniques non-pharmacologiques "positives" telles une douce musique ou encore des exercices d'imagerie mentale supportent cette idée de modulation. Dans le cas des approches et techniques "positives", cette modulation se fait alors
• par l'activation des faisceaux descendants inhibiteurs par les centres limbiques qui font relais vers la SGPA qui fait ensuite relais vers les noyaux raphé du bulbe.
Alors que l'application de stimulation médullaire directe par un neurostimulateur interne produit une modulation par au moins trois mécanismes, soient par une activation
• directe des faisceaux descendants inhibiteurs (ils sont à proximité des faisceaux postérieurs)
• indirecte des faisceaux descendants inhibiteurs (l'activation des faisceaux postérieurs entraîne une activation des relais tronculaires qui activent à leur tour les faisceaux descendants principalement à partir de la substance grise périaqueducale (SGPA)
et
• rétrograde ou antidromique des faisceaux postérieurs qui avant de faire leur ascension vers les étages supérieures ont envoyé des projections aux étages médullaires où ils sont entrés. Les électrodes appliquées sur les cordons postérieurs provoquent des influx qui vont à la fois faire leur ascension vers les structures tronculaires pour activer des influx inhibiteurs descendants et à la fois "redescendre" (ce sont les influx antidromiques) pour se terminer aux extrémités des projections envoyées vers la corne postérieure dans les couches III et IV. Ces projections arrivent sur des interneurones qui vont moduler la neurotransmission nociceptive en pré-synaptique et/ou en post-synaptique.
- L'effet final est toujours le même: c'est celui d'une modulation exercée au niveau de la corne postérieure.
Les fibres "modulatrices" proviennent donc de deux sources:
-
• de la périphérie (fibres A alphaet A bêta) ce qui donne le portillon segmentaire,
• des régions centrales inhibitrices (principalement des structures du tronc cérébral) ce qui donne le portillon extra-segmentaire. Voir LA CONTREPARTIE DES FAISCEAUX ASCENDANTS: LES FAISCEAUX DESCENDANTS INHIBITEURS.
Les fibres des faisceaux inhibiteurs desdendants produisent leur modulation soit directement, soit par l'intermédiaire d'interneurones alors que les fibres A alpha et A bêta produisent leur modulation uniquement par l'intermédiaire d'interneurones.
Les interneurones, activés par ces différentes fibres "modulatrices" peuvent faire synapse
-
• avec les boutons pré-synaptiques des fibres périphériques,
• avec les membranes post-synaptiques du corps cellulaire des fibres centrales,
ou
• avec les membranes post-synaptiques des dendrites des fibres centrales.
L'inhibition peut donc se faire à deux endroits:
-
• en pré-synaptique
et
• en post-synaptique.
En pré-synaptique, l'inhibition provient particulièrement des faisceaux descendants dorso-latéraux et cette inhibition se fait directement de préférence sur les boutons pré-synaptiques des fibres A delta et à un degré moindre sur les boutons pré-synaptiques des fibres C.
En post-synaptique, l'inhibition peut se faire
-
• directement par les fibres du faisceau dorso-latéral (2e fibre du FDL à droite) bien que ce mode de modulation soit moins important que le mode pré-synaptique pour les fibres du faisceau dorso-latéral
• indirectement sur le corps cellulaire ou sur les dendrites du neurone central
• par un interneurone ou neurone intercalaire qui lui, fait synapse directement avec le corps cellulaire du WDR (1-3-4e fibre du FDL à droite), c'est le mode utilisé par un certain nombre de fibres des faisceaux descendants
• par une cellule pédonculée qui elle, fait synapse directement avec le corps cellulaire du WDR (1-3-4e fibre du FDL à droite) (5e fibre du FDL à droite), c'est le mode utilisé de façon préférentielle par les fibres A alpha et A bêta.
Les fibres des faisceaux inhibiteurs descendants exercent leur modulation par deux neurotransmetteurs,
-
• la sérotonine
et
• la norépinéphrine
alors que les interneurones "inhibiteurs" font usage préférentiellement de trois neurotransmetteurs (NT) :
-
• l'enképhaline
• la dynorphine
et
• le GABA.
Des récepteurs "biochimiques" de type sérotoninergiques, adrénergiques, opiacés et de type GABA sont présents en pré et en post-synaptique. L'activation de ces récepteurs produit des effets biochimiques différents selon le type de récepteur et selon le contexte présynaptique ou postsynaptique mais l'effet final converge dans le même sens, celui de réduire la neurotransmission des influx nociceptifs.
-
• Au niveau du bouton pré-synaptique, l'activation des récepteurs de type sérotoninergiques, adrénergiques, opiacés et de type GABA entraîne une réduction de l'activité métabolique intrinsèque ce qui a pour effet de réduire la production et la libération des NTs nociceptifs habituellement observés lorsqu'un influx nociceptif arrive au niveau du bouton pré-synaptique (Voir: LA TRANSMISSION D'UN INFLUX DANS L'ESPACE SYNAPTIQUE: LES NTs "INHIBITEURS", L'HYPERPOLARISATION ET LES EFFETS SUR LE BOUTON PRE-SYNAPTIQUE ET LE NEURONE CENTRAL)
• Au niveau de la membrane post-synaptique autant du corps cellulaire que de ses dendrites, l'activation des récepteurs de type sérotoninergiques, adrénergiques, opiacés et de type GABA entraîne une "hyperpolarisation "prolongée". Cette hyperpolarisation de la membrane post-synaptique entraîne un niveau de "voltage" transmembranaire encore plus négatif que le potentiel de repos appartenant à ces neurones. Cette hyperpolarisation, qui est en fait une accentuation de la négativité intracellulaire, a pour effet d'empêcher la membrane post-synaptique de réagir à l'arrivée d'un NT nociceptif provenant de la membrane pré-synaptique. La membrane post-synaptique devient donc "non réceptive" au NT nociceptif libéré puisque la dépolarisation provoquée par le NT nociceptif ne peut plus atteindre le seuil d'activation nécessaire à la production d'un influx nociceptif (i.e. un potentiel d'action). (Voir: LE PHENOMENE DE DEPOLARISATION "MEMBRANAIRE" et LA TRANSMISSION D'UN INFLUX DANS L'ESPACE SYNAPTIQUE: LES NTs "INHIBITEURS", L'HYPERPOLARISATION ET LES EFFETS SUR LE BOUTON PRE-SYNAPTIQUE ET LE NEURONE CENTRAL)
D'une façon comme d'une autre, il en résulte une très nette réduction du nombre d'influx nociceptifs prenant la direction des centres supérieurs soit parce que moins de NTs nociceptifs sont libérés, soit à cause de l'impossibilité pour les NTs nociceptifs qui restent de provoquer une dépolarisation suffisante de la membrane post-synaptique pour créer un influx nociceptif. Moins d'influx signifie moins de douleur!
L'effet portillon s'exerce en autant que la corne postérieure reçoive la profusion d'informations sensitives de toutes sortes, nociceptives et autres qu'elle devrait recevoir, or, cette profusion d'informations est en équilibre homéostatique et respecte une "chimie architecturale" merveilleusement bien orchestrée. Lorsque cette "chimie architecturale" est perdue, c'est-à-dire, lorsque des lésions sont causées au niveau des différentes fibres sensitives périphériques transportant des influx autres que nociceptifs, ce qui concerne les fibres A alpha, A bêta et certaines fibres A delta, il se produit alors un déséquilibre dans l'arrivée des informations sensitives de toutes sortes. Ce déséquilibre a pour effet de faciliter le transfert des influx nociceptifs au niveau de la corne postérieure en raison, pour une part, de la réduction des inhibitions homéostatiques normalement présentes par l'intermédiaire de l'activation des interneurones décrits plus haut.
La perte des influx en provenance des fibres larges (A alpha et A bêta) et des fibres A delta non-nociceptives i.e. la destruction de ces fibres conduit à l'ouverture du portillon i.e. conduit à la facilitation du transfert, sans aucune forme d'inhibition, de tous les influx nociceptifs en provenance des fibres nociceptives petites (A delta et C). L'effet portillon segmentaire est alors perdu.
La théorie du Contrôle Inhibiteur Diffus induit par la Nociception (CIDN) a été développée plus récemment. Cette théorie fait appel à un ensemble de structure débutant avec les neurones à convergence (WDR). Les WDR donnent origine principalement au faisceau paléo-spino-thalamique et à un de ses sous-faisceaux, le spino-réticulaire. Un sous-groupe de fibres de ces réseaux se projettent vers de nombreuses structures de la formation réticulée bulbaire dont particulièrement le noyau Subnucleus Reticularis Dorsalis dont les neurones ont comme particularité de répondre à tous les types de stimuli nociceptifs peu importe leur origine (peau, muscles/os/articulations, viscères).
Les WDR de la couche V de la corne postérieure sont soumis en permancence à tous les types d'afférences sensorielles et à tous les types d'afférences nociceptives ... si des afférences nociceptives sont présentes. Or, toute survenue d'une information nociceptive sur un certain nombre de neurones WDR est d'abord "fondue" avec les autres informations dans le bruit de fond somesthésique auquel est soumis le WDR.
Cependant, la survenue d'une stimulation nociceptive et le transfert de cette information sur un certain nombre de WDR a pour effet d'activer le sous-groupe de fibres paléo-spino-thalamiques et spino-réticulaires décrit plus haut ce qui a pour conséquence d'activer de façon particulière certaines structures des centres supérieurs dont le noyau Subnucleus Reticularis Dorsalis de la formation réticulée bulbaire. Ce noyau spécifique semble se comporter comme un "premier senseur" nociceptif et il agit immédiatement à la moindre réception de signaux nociceptifs. Il agit cependant d'une étrange manière car il effectue alors une inhibition non pas du transfert des influx nociceptifs aux étages concernés mais une inhibition de l'ensemble des signaux sensoriels de base arrivant à la fois sur les WDR concernés et à la fois sur les WDR des autres étages segmentaires non concernées par les transferts nociceptifs. Ce faisant, il réussit à isoler les transmissions pour ne conserver que "les fréquences nociceptives" qui se trouvent alors "mieux perçues" en raison de la réduction du bruit de fond multisensoriel habituel. Le noyau Subnucleus Reticularis Dorsalis augmente ainsi les contrastes entre les transmissions nociceptives et les transmissions sensorielles non-nociceptives.
Un tel mécanisme semble paradoxal à première vue puisque les Contrôles inhibiteurs induits par la stimulation nociceptive ont pour effet dans un premier temps "d'amplifier" ou de "faciliter" la neurotransmission des messages nociceptifs. Tout se déroule comme si ces CIDN réussissaient à réduire la fonction de poly-convergence des WDR qui pour une période donnée ne deviennent réceptifs qu'aux influx nociceptifs.
Une fois les influx nociceptifs bien isolés et bien interprétés, ces influx nociceptifs deviennent alors soumis à l'ensemble des influx inhibiteurs descendants qui reçoivent alors la permission de s'exprimere et de jouer alors leur plein rôle de réduire la neurotransmission nociceptive aux étages segmentaires concernés.
Comme autre particularité des CIDN, ceux-ci peuvent être inhibés par la morphine ce qui a pour effet de "rétablir" et peut-être même d'accentuer le bruit de fond somesthésique provenant de l'ensemble des afférences sensorielles et arrivant sur les neurones à large convergence (WDR). Ce faisant, le message nociceptif se trouve ainsi de nouveau "dilué" au sein des multiples messages sensoriels puisque les CIDN ne peuvent plus isoler le signal nociceptif pour un certain moment.
92 - Le faisceau spinothalamique: ses deux subdivisions (paleo et neo)
Le faisceau spinothalamique connaît deux subdivisions:
-
paléo-spinothalamique
et - néo-spinothalamique.
Le FAISCEAU NEO-SPINOTHALAMIQUE se charge particulièrement de la fonction de transporter la NOCICEPTION à laquelle s'ajoute la composante "PROPRIOCEPTION NOCICEPTIVE", c'est donc dire une information "DOULEUR" à laquelle s'ajoute en même temps les informations portant sur la localisation, l'intensité en terme d'échelle de douleur, la surface et la durée pour la ou les douleurs concernées.
Ce faisceau reçoit des messages provenant en nette prédominance du réseau somatique et il est composé de fibres myélinisées "A delta".
Le réseau viscéral nociceptif, quant à lui, n'est pas muni du raffinement proprioceptif que le réseau somatique possède, de plus, il "transmet" surtout par les fibres "C". Il contribue donc peu au faisceau néo-spinothalamique mais contribue beaucoup au faisceau paléo-spinothalamique.
Le FAISCEAU PALEO-SPINOTHALAMIQUE quant à lui, transporte l'information NOCICEPTION à laquelle s'ajoute la composante "EMOTION NOCICEPTIVE", c'est donc dire une information "DOULEUR" à laquelle s'ajoute en même temps les informations portant sur les composantes affectives et comportementales pour la ou les douleurs concernées.
Ce faisceau est composé de fibres "C". Il transporte aussi les informations concernant le toucher léger superficiel.
93 - Le faisceau neo-spinothalamique
Après avoir fait synapse avec les fibres périphériques, le faisceau néo-spinothalamique fait son ascension directement vers le thalamus. Dans sa portion centrale, il ne fera synapse qu'une seule autre fois à partir de son entrée dans la moelle au niveau de la corne postérieure et ce jusqu'au thalamus, on le dit monosynaptique. Le fibres de ce faisceau sont dirigées vers le thalamus et vers certains noyaux préférentiels seulement. A partir du thalamus, une troisième longueur d'axones se rend spécifiquement dans le cortex pariétal sensitif où se font la réception (cortex pariétal primaire (S1) et l'intégration (cortex paritétal secondaire (S2) du message "DOULEUR" et "TOUCHER SUPERFICIEL". (Voir: LE POINT D'ARRIVEE DES INFLUX NOCICEPTIFS: LES ETAGES SUPERIEURS "MODE SENSORIEL" ET "MODE AFFECTIF")
Il importe de préciser qu'aucune composante affective ou émotionnelle n'est incluse dans la transmission par le faisceau néo-spinothalamique.
94 - Douleur = nociception: trop simpliste
Soutenir que la douleur ne puisse être que la simple perception de la nociception serait donc une affirmation beaucoup trop simpliste, immensément trop simpliste, parce que...
95 - Douleur = intégration
Quand on réfère à la douleur, on réfère bien sûr à la nociception, mais on réfère aussi à l'intégration d'une multitude d'autres influx physiques et non-physiques, le tout se déroulant dans une même et unique personne: celle qui a mal. Le faisceau paléo-spinothalamique n'est pas étranger à ce processus complexe d'intégration.
96 - Le faisceau paleo-spinothalamique et les autres
En fait, le vieux, très vieux faisceau paléo-spinothalamique avec les autres faisceaux, spino-réticulaires, spino-mésencéphaliques et spino-solitaires viennent se charger de nous rappeler que le phénomène de douleur globale ou totale n'est pas qu'une vue de l'esprit, il possède aussi son substrat anatomo-physiologique. (Voir: LE POINT D'ARRIVEE DES INFLUX NOCICEPTIFS: LES ETAGES SUPERIEURS "MODE SENSORIEL" ET "MODE AFFECTIF")
Le faisceau paléo-spinothalamique nous vient en héritage de la nuit des temps, du temps où dans l'évolution de la vie, nos "arrières-arrières-arrières" grands-parents étaient ... des poissons. Du temps où la nature était fort économe et ne pouvait se permettre de fabriquer autre chose que des fibres C, toutes petites et sans gaine protectrice de myéline.
C'est au moyen des fibres "C" que nos arrières-arrières-arrières grands-parents les poissons ont commencé à éprouver de la douleur.
Plus tard, beaucoup plus tard, avec le développement des espèces et jusqu'à l'aboutissement de l'homo sapiens sapiens d'aujourd'hui, se sont ajoutés des centres nerveux de plus en plus élaborés et complexes dans le cerveau. A travers ce lent processus d'évolution et d'adaptation, le système nerveux central s'est toujours "préoccupé" de faire parvenir vers des centres nerveux désignés, une portion de l'information douloureuse, en "branchant" un certain nombre de fibres C nociceptives à ces différents centres.
C'est ainsi qu'aujourd'hui, le cerveau humain reçoit, principalement
-
par l'intermédiaire du faisceau paléo-spinothalamique
-
mais aussi par les faisceaux
- spino-réticulaires (portion médullaire antéro-latérale)
-
spino-mésencéphaliques (portion médullaire antéro-latérale)
et - par quelques autres faisceaux (spino-solitaires et autres) encore plus ou moins bien connus,
des informations "NOCICEPTIVES" dans de nombreuses zones impliquées dans la gestion et l'intégration de la vie émotive et comportementale.
Parmi ces zones recevant des messages électriques "NOCICEPTIFS", il importe de retenir:
- la formation réticulée dans la région du "nucleus reticularis gigantocellularis"
- le système limbique
- certains noyaux thalamiques différents de ceux impliqués dans le relais néo-spinothalamique
- la substance grise périaqueducale (mésencéphale)
- le cortex frontal.
Ces différentes zones sont à leur tour interconnectés pour ajouter encore plus d'effets modulateurs sur les influx reçus.
Il est bien connu par exemple que le système limbique est responsable de la gestion de nos humeurs, c'est-à-dire du monde complexe de toutes nos émotions.
Le cortex frontal quant à lui, est responsable en bonne partie de notre comportement social, pour ne citer que ces deux exemples.
Le FAISCEAU PALÉO-SPINOTHALAMIQUE ayant dû s'adapter, de même que les autres faisceaux "NOCICEPTIFS", à la complexification du cerveau des différentes espèces, est devenu, à travers l'évolution, un réseau multi-étagé, c'est-à-dire un réseau auquel se sont ajoutées de nombreuses "projections" axonales. Chaque "projection" permettait ainsi d'allonger le faisceau, de le prolonger vers de nouvelles zones et de nouvelles structures et donc d'entraîner une intégration de plus en plus élaborée des informations. C'est ainsi que l'on réfère au faisceau paléo-spinothalamique, dans le jargon, comme étant un réseau muni de nombreux relais synaptiques, on le qualifie de polysynaptique.
Il importe de préciser qu'aucune composante proprioceptive n'est incluse dans la transmission par le faisceau paléo-spinothalamique.
Le faisceau néo-spinothalamique pour sa part, datant d'une époque beaucoup plus récente, est demeuré monosynaptique à partir de son origine dans la moelle au niveau de la corne postérieure et ce jusqu'au thalamus.
Les influx nociceptifs ainsi transmis par l'intermédiaire de plusieurs structures (paléo-spinothalamique) arrivent enfin aux différentes composantes du système limbique où se fera l'intégration de la composante "EMOTIVE" des douleurs.
97 - La douleur: définition (Internal Association for the Study of Pain (IASP))
La douleur est donc beaucoup plus que la perception de la nociception, puisqu'elle englobe des informations gérées à la fois par les circuits
- somato-sensoriels (faisceau néo-spino-thalamique - noyaux thalamiques ventro-latéral postérieur (VLP) et complexe nucléaire postérieur (PO) - cortex somesthésique pariétal primaire (SI) i.e. l'homonculus
et
- affectivo-comportementaux (faisceau paléo-spinothalamique - noyaux thalamiques parafasciculaires, dorso-médians (NDM) et centro-médians (NCM) et certains noyaux intra-laminaires - structures limbiques (amygdale), hypothalamus et structures corticales associatives (cortex cingulaire)
(Voir: LE POINT D'ARRIVEE DES INFLUX NOCICEPTIFS: LES ETAGES SUPERIEURS "MODE SENSORIEL" ET "MODE AFFECTIF")
L'International Association for the Study of Pain (IASP) a suggéré à partir de 1986 une définition de la douleur que l'on retrouve encore comme un classique un peu partout dans la littérature.
Une portion de cette définition s'énonce comme suit:
La douleur est "... une expérience désagréable, sensorielle et émotive associée avec des dommages tissulaires actuels ou potentiels..."
98 - La douleur: définition "révisé"
Cependant, dans les contextes de douleurs physiques avec un substrat organique en cause (cancer, SIDA, autres pathologies organiques débilitantes) et tout particulièrement à la lumière de ce qui a été décrit précédemment, il serait possible d'imaginer une sorte de définition révisée qui pourrait être énoncée ainsi:
La douleur est: "... une expérience désagréable, sensorielle et émotive, associée, à son point de départ, avec des dommages tissulaires actuels ou potentiels ... et résultant de l'intégration d'un mal dans la chair et dans l'être."
99 - La douleur: définition d'une personne qui avait mal
Une personne qui avait mal, rencontrée un jour dans le cadre d'une consultation en soins palliatifs, a fourni, en quelques mots, probablement la plus élégante et la plus complète définition de la douleur. Elle témoignait, dans des mots simples, de la résultante finale de l'intégration des différentes informations douloureuses et émotives dans une même personne.
L'énoncé de cette personne avait été d'une brièveté et d'une sobriété percutante. Ses quelques mots s'énonçaient ainsi:
"J'ai tellement mal que je suis mal.".
Une telle affirmation s'avère tout le contraire de l'énoncé empreint du classicisme gréco-latin:
"Anima sana in corpore sano". (Une âme saine dans un corps sain)
Ces quelques mots marquaient et marquent encore probablement aujourd'hui une très précise et très précieuse définition du concept de douleur globale ou douleur totale.
100 - Douleur et souffrance
Il devient donc important à partir de maintenant de bien dissocier deux termes souvent utilisés de façon confondante soient DOULEUR et SOUFFRANCE.
Le terme "DOULEUR" pourrait être réservé à la douleur physique, c'est-à-dire à la perception de la nociception pure.
Le terme "SOUFFRANCE" pourrait s'appliquer au concept de douleur globale, c'est-à-dire à la résultante finale s'exprimant dans un état d'être et découlant finalement de l'intégration entre les informations
-
en provenance des différents circuits nociceptifs
- néo-spinothalamiques
- paléo-spinothalamiques
- spino-réticulaires
-
spino-mésencéphaliques
et -
par les autres faisceaux (spino-solitaires et autres) encore plus ou moins bien connus
- celles gérées par les circuits somato-sensoriels
- celles gérées par les circuits affectivo-comportementaux.
Dans plusieurs contextes pathologiques où maladies et douleurs se côtoient, les composantes affectives et comportementales découlent à la fois des impacts provoqués par la douleur physique et à la fois des impacts provoqués par le fait d'avoir telle ou telle maladie. Ces mêmes composantes sont ressenties dans différentes dimensions de la vie "non-physique" qui seront discutés ultérieurement. Le contexte des soins palliatifs oncologiques est souvent une touchante illustration de ces affirmations.
101 - Le contexte soins palliatifs "oncologiques": évolution néoplasique et impacts physiques

Les atteintes physiques découlant des atteintes néoplasiques sont souvent multisites, ces atteintes touchent un ensemble de systèmes ou d'organes dans lesquels différents symptômes physiques, dont la douleur, peuvent se manifester. Les symptômes découlant des atteintes au niveau physique sont alors mis en évidence au moment de la revue des systèmes.
Il est ainsi classique de faire référence aux différents systèmes suivants lors de toute évaluation:
- nerveux,
- psychiatrique,
- O.R.L.,
- endocrinien,
- cardio-vasculaire,
- respiratoire,
- digestif,
- urinaire,
- reproducteur,
- locomoteur,
- dermatologique.
Cet exercice de revue des systèmes permet d'identifier des problèmes physiques dans l'ensemble des sphères de la composante somatique. Cette façon de percevoir l'étendu des impacts physiques permet par ailleurs d'en faire un parallèle avec l'autre monde, celui du psyché, où se déroule, dans le contexte des douleurs sévère et prolongée, une intense activité dont les répercussions sur chaque personne qui a mal risque parfois d'être marquante pour de longues périodes de vie. L'exercice de revue des systèmes peut être élargi afin de s'adresser aux impacts non-physiques. Il devient alors possible d'avoir une certaine assurance que l'ensemble des impacts à la fois dans le corps (impacts physiques) et dans l'être (impacts non-physiques) a été adéquatement identifié.
102 - Le contexte soins palliatifs "oncologiques": évolution néoplasique et impacts non-physiques
Tout comme il existe un ensemble de systèmes organiques dont il a été fait mention précédemment, il existe aussi différentes dimensions de la vie où peuvent être ressentis et vécus les multiples impacts en rapport avec la douleur et la maladie.
De tels impacts peuvent ainsi être vécus dans chacune des dimensions suivantes de la vie:
- personnelle,
- conjugale,
- familiale,
- professionnelle,
- économique,
- sociale,
- spirituelle,
- ethno-culturelle.
C'est à ces différentes dimensions que l'on s'adressera lors de l'évaluation des personnes qui ont mal. La recherche des impacts non-physiques devrait se faire idéalement en parallèle avec la revue des systèmes physiques. On l'appellera la revue des domaines de vie pour faire le pendant avec la revue des systèmes physiques.
Le "comment" sera explicité dans le Manuel II portant sur l'évaluation des douleurs.
103 - Le contexte soins palliatifs "oncologiques": la douleur et le monde des émotions
La douleur, la maladie et les impacts qui en découlent, tant physiques que non-physiques, touchent directement le monde des émotions. Ce monde porte en chacun de nous trois vieux sentiments qui accompagnent la nature humaine depuis très longtemps dans l'histoire de l'humanité. Ces trois vieux sentiments sont de plus très intimement reliés l'un à l'autre.
Ils sont:
- l'angoisse ou l'anxiété,
- la tristesse ou la dépression,
- la colère.
De nombreux contextes de vie risquent de venir alimenter et même accentuer très nettement ces vieux sentiments quand une personne qui a mal se trouve au prise avec le cancer, le SIDA ou encore une maladie débilitante organique.
Parmi ces contextes se trouvent des peurs, souvent nombreuses, et des pertes, tout autant nombreuses, parfois cruellement imposées par les douleurs et la maladie. Peurs et pertes guettent malheureusement tous et chacun au prise avec ces conditions. Ainsi commence donc, avec un tel duo, le bal infernal des sentiments négatifs. Un risque très net existe cependant de voir ces sentiments négatifs prendre de plus en plus de place chez la personne qui souffre. Un bal donc qui risque de se terminer en cauchemar pour plusieurs qui ont mal.
L'effet net de ces trois "vieux" sentiments, combien encore actuels, sera de venir rehausser, parfois très considérablement, l'intensité des douleurs physiques ressenties par la personne qui a mal, intensité à laquelle on réfère souvent en terme d'échelle de douleur mais qui en fait véhicule aussi les dimensions désagréables de la douleur.
Le monde des émotions joue donc un rôle-clé modulateur dans l'échelle de la douleur. Bien plus, il est aussi responsable de l'autre échelle, celle de la souffrance devrait-on dire plus précisément. Et ce rehaussement de l'échelle des douleurs causé par une telle influence "négative" modulatrice des vieux sentiments humains ne répondra que très peu aux approches pharmacololgiques antalgiques usuelles qui incluent très souvent des opiacés. En fait, les opiacés n'ont jamais été des anxiolytiques, ils ne le sont pas encore et ne le seront jamais.
Il faudra donc se tenir toujours très loin de l'association malsaine et regrettable à laquelle la méconnaissance des différentes sortes de douleur et de la gestion analgésique peut mener, soit DOULEUR EGALE OPIACES ou encore de cette autre association tout aussi malsaine et regrettable soit LA DOULEUR AURAIT DÛ DIMINUER AVEC LES OPIACÉS. La douleur est un phénomène beaucoup trop complexe pour des associations aussi réductrices. Il y a beaucoup plus à considérer et à faire.
104 - La douleur globale: ses impacts cognitifs et émotifs
Douleurs et maladie sont de mauvais amalgames. Douleurs et cancer sont probablement pires encore. Au niveau cognitif, les impacts sont souvent nombreux. La concentration, la mémoire, la capacité d'apprentissage, de conceptualisation, d'élaboration sont souvent mis à rudes épreuves. C'est en fait toute la manière de penser et de fonctionner de la personne atteinte qui se trouve "ébranlée".
A lui seul, le rehaussement de la douleur physique découlant de l'ensemble des répercussions associées à la douleur et à la maladie (cancer, SIDA, maladie organique débilitante) vient déjà affecter les processus cognitifs, mais il y a plus. Ces répercussions affectent souvent en profondeur le monde des émotions qui devient comme "baigné" dans un univers de courants négatifs. A tout cela s'ajoute, enfin, l'effet amplificateur néfaste des trois vieux sentiments sur la personne: voilà de quoi entraîner, de toute évidence, d'assez fortes perturbations dans la manière de penser et de fonctionner de la personne atteinte et même dans le processus de la pensée lui-même.
Ces perturbations sont à ce point observables qu'il arrive très souvent que la personne atteinte:
- n'a pas pris conscience qu'elle avait plus d'une sorte de douleur,
-
n'arrive pas toujours d'emblée à bien localiser
ses douleurs, elle dit souvent qu'elle a mal partout, - n'a pas perçu tous les inconforts tels
angoisse,
colère,
tristesse,
désarroi,
peur,
qu'elle est en train de vivre ou "plutôt" de subir dans les nombreuses dimensions de sa vie
-
- personnelle,
- conjugale,
- familiale,
- professionnelle,
- économique,
- sociale,
- spirituelle,
- ethno-culturelle.
En somme, l'expression de la souffrance énoncée dans le: "J'ai tellement mal que je suis mal", est à ce point vrai qu'il est difficile d'imaginer de la/des douleurs sans qu'il existe des conséquences sur la vie affective et intellectuelle de toute personne soumise à une ou des douleurs qui se prolongent le moindrement.
105 - La douleur chronique: le cercle vicieux
Et plus la douleur se prolonge, plus la personne qui a mal s'engouffre progressivement dans un cercle vicieux dont il devient à peu près impossible de sortir sans une aide quelconque extérieure.
Ainsi, plus la douleur physique augmente, plus le sommeil se trouve affecté et réduit tant en qualité qu'en quantité. Plus le sommeil se trouve perturbé, plus les vieux sentiments deviennent prédominants. Plus les vieux sentiments deviennent prédominants, plus l'anxiété augmente, plus la tristesse et le désespoir, mêlés ou non à de la colère, prennent de la place dans la vie affective de la personne. Plus les vieux sentiments deviennent prédominants, plus la personne a tendance alors à réduire ses activités de vie quotidienne et sa vie sociale. Plus les activités de vie quotidienne et de vie sociale sont réduites, plus la personne s'isole. Plus la solitude devient grande, plus l'isolement devient lourd et plus s'additionnent les facteurs d'une grande souffrance.
Cette alchimie néfaste qui se déroule dans la composante affective ou émotionnelle de la vie a pour conséquence, parmi d'autres, d'entraîner un abaissement du seuil de la douleur. L'abaissement du seuil de douleur signifie alors une plus forte perception de la douleur physique, c'est ainsi que la spirale inflationniste de la douleur et de la souffrance s'accélère et se creuse de plus en plus avec le temps.
La personne qui a mal s'en trouve prisonnière. Décidément, la douleur chronique est un mal redoutable et une fort mauvaise compagne de tous les jours.
106 - La douleur chronique: définition
Plus la douleur se prolonge, plus la douleur se conforme à une des définitions de la douleur chronique.
La douleur chronique, au sens de la définition propre, telle qu'on peut la retrouver dans la littérature, est une douleur qui répond à un ou plusieurs des trois critères suivants. Elle est une douleur qui:
- récidive par intervalle sur une période de mois ou d'années
- persiste plus d'un mois au-delà de la période habituelle d'une douleur aiguë
- est reliée à un processus pathologique chronique.
On devrait facilement accepter qu'il ne soit pas nécessaire d'atteindre cette définition "à la lettre" pour en imaginer tous les impacts particulièrement celui de l'emprisonnement dans un cercle vicieux des plus néfastes.
En fait, dès que la douleur se prolonge le moindrement, elle commence déjà à faire subir ses contrecoups. Personne, absolument personne d'entre-nous n'est à l'abri de ces contrecoups.
107 - Classification des douleurs: contexte "soins palliatifs oncologiques"
Afin d'en arriver à avoir une vue d'ensemble des différentes douleurs, il importe d'en fournir un mode de classification. Il existe plusieurs façons de classifier les douleurs selon l'angle sous lequel on examine celles-ci. L'IASP en offre le standard depuis des années.
La classification proposée dans la présente série "Ces personnes qui ont mal" concerne les douleurs physiques rencontrées dans un contexte de soins palliatifs oncologiques. Elle repose sur une combinaison entre les bases anatomo-patho-physiologique et clinique et se veut un résumé fort simple en même temps qu'un aide-mémoire des classifications souvent plus complexes que l'on retrouve dans la littérature médicale. Elle ne se retrouve nulle part dans la littérature classique puisqu'elle est un hybride de plusieurs sous-formats de classification. Cette classification telle que proposée dans le projet actuel n'a jamais été publiée jusqu'à maintenant bien qu'elle ait été présenté des centaines de fois dans des conférences et qu'elle soit l'outil de tous les jours dans le milieu universitaire où l'auteur oeuvre.
Cette façon de voir ou de comprendre les douleurs se veut en même temps un outil facile à mémoriser et à utiliser au chevet de chaque personne qui a mal.
Malgré son extrême simplicité, cette classification regroupe la très très grande majorité des entités douloureuses rencontrées en cliniques de soins palliatifs oncologiques, elle permet ainsi de poser des diagnostics chez la grande majorité des personnes évaluées dans de tels contextes.
Ses bases anatomo-patho-physiologique et clinique font en sorte que son utilisation peut s'étendre à d'autres contextes d'atteinte organique (diabète, post-chimiothérapie, SIDA etc.).
Cette classification "simplifiée" ne représente bien sûr qu'une partie du tableau "douloureux". Elle représente la douleur ressentie "dans le corps" i.e. la douleur physique alors qu'il existe deux contreparties pour la douleur non-physique:
- la contrepartie psychogène, i.e. la douleur qui s'apparente en tout point, dans la façon dont elle se présente, à une douleur ressentie "dans le corps" mais pour laquelle aucune lésion tissulaire ni neuronale ne peut cependant être démontrée ... dans l'état des possibilités techniques au moment de l'investigation!!!
Le chapitre des douleurs chroniques psychogènes i.e. sans aucune pathologie organique "décelable" ne fait pas l'objet de ce manuel ni de la présente série. Ce chapitre mérite une perspective d'analyse et une approche relativement plus élaborée que celle présentée dans les six manuels de la présente série "Ces personnes qui ont mal". La perspective de cette série concerne les douleurs rencontrées en soins palliatifs oncologiques et ne prétend pas s'étendre aux perspectives que les cliniques de douleur chronique doivent rencontrer.
- la contrepartie "douleur ressentie dans l'âme". Cette portion des douleurs non-physiques repose sur des bases psycho-socio-spirituelles et représente la portion "souffrance" des douleurs. Elle figure dans le deuxième volet de ce manuel.
Le chapitre des douleurs chroniques psychogènes i.e. sans aucune pathologie organique "décelable" ne fait pas l'objet de ce manuel ni de la présente série. Ce chapitre mérite une perspective d'analyse et une approche relativement plus élaborée que celle présentée dans les six manuels de la présente série "Ces personnes qui ont mal". La perspective de cette série concerne les douleurs rencontrées en soins palliatifs oncologiques et ne prétend pas s'étendre aux perspectives que les cliniques de douleur doivent rencontrer.
L'explication de l'entité non-physique "ressentie dans l'âme" avec ses bases psycho-socio-spirituelles figure dans le deuxième volet de ce manuel. La première partie se limite aux bases anatomo-patho-physiologiques et cliniques de la douleur.
Une bonne connaissance des deux entités complémentaires (douleurs physiques et souffrance) permet de mieux saisir
-
la puissante intégration qui existe entre les douleurs physiques et les composantes non-physiques (psycho-socio-spirituelles)
et -
l'effet de cette intégration chez une seule et même personne lorsque ces deux composantes sont combinées ensemble.
Les expressions "douleur globale", "douleur totale" et "approche globale" ne devraient ainsi être utilisée qu'après
-
avoir identifié, au moment du processus de l'évaluation, les différentes composantes physiques et non-physiques des douleurs
et - en avoir tenu compte dans le plan de gestion analgésique global.
Lorsque ces conditions ne sont pas respectées, de telles expressions deviennent rapidement vides de sens. Il ne sert pas à grand chose non plus d'en disserter longuement "pour le plaisir de disserter" si on n'a pas exploré avec la personne qui a mal toutes les dimensions de vie "heurtéés" par les douleurs et si la personne qui a mal ne bénéficie pas d'interventions qui témoignent d'un souci de ces différentes dimensions.
108 - Classification des douleurs: trois modes de classification revus succinctement
La classification proposée, regroupant quatre entités, anatomiques, physiologiques, pathologiques et cliniques représente une classification hybride puisqu'elle contient des portions provenant de ces différentes entités. Avant d'en arriver à cette classification "simplifiée", trois modes de classification sont revus succinctement afin d'illustrer le recoupement que la classification "hybride" offre. Ces trois classifications concernent les trois angles suivants:
- anatomo-physiologique
-
clinique
et - anatomo-patho-physiologique.
109 - Une classification "anatomo-physiologique" des douleurs physiques
Une classification plus "uniforme" des douleurs se limitant par exemple au volet "anatomo-physiologique" pourrait offrir la vision suivante.
Il existe deux grandes familles de douleur:
-
les douleurs NOCICEPTIVES
et - les douleurs NEUROGENES (ou neuropathiques).
Chacune de ces deux grandes familles de douleurs se subdivise à son tour.
La douleur NOCICEPTIVE comprend deux sous-types anatomiques:
-
-
la douleur somatique
et -
la douleur viscérale.
-
la douleur somatique
La douleur NEUROGENE, quant à elle, comprend deux différents sous-types anatomiques
-
-
les atteintes du réseau somatique
et -
les atteintes du réseau autonome ou splanchique.
-
les atteintes du réseau somatique
Pour chacune des douleurs NEUROGENES TANT SOMATIQUES QU'AUTONOMIQUES, l'atteinte peut se situer dans deux sous-portions anatomiques:
-
-
les neurones périphériques
et -
les neurones centraux.
-
les neurones périphériques
Cette façon de classifier n'offre aucune information "clinique", à savoir par exemple sur les façons dont les douleurs peuvent être ressenties (constance, intensité, caractère ressenti ... ). Cette classification ne permet pas non plus d'orienter la gestion analgésique particulièrement en regard du choix parmi l'arsenal des analgésiques et des co-analgésiques.
110 - Une classification "clinique" des douleurs physiques
Une classification purement clinique permet de dégager les différents caractères par lesquels les douleurs peuvent se manifester. Cette classification plus "uniforme" des douleurs se limitant cette fois-ci au volet "clinique" pourrait offrir la vision suivante.
Les douleurs possèdent trois grands caractères cliniques:
-
• le caractère "TEMPOREL" des douleurs
• le caractère "QUALITE OU SENSATION PARTICULIERE"
• le caractère "INTENSITE".
Le caractère "TEMPOREL" des douleurs peut se définir selon deux modes de présentation:
-
• la constance
• l'intermittence.
-
La douleur CONSTANTE peut présenter son intensité sous sous trois modes:
• constance avec intensité constante
• constance avec intensité un peu variable
• constance avec intensité très variable mais sans jamais disparaître complètement sinon cette dernière deviendrait intermittente.La douleur INTERMITTENTE peut se présenter sous deux modes:
• un début progressif
• un début extrêmement soudain.La douleur INTERMITTENTE, peu importe son mode de présentation repose sur deux paramètres:
• la durée
• l'intensitéL'INTENSITE DE LA DOULEUR INTERMITTENTE peut manifester les deux types suivants:
• une intensité identique pour chaque survenue de douleur
• des intensités variables à chaque survenue de douleur.LA DUREE DE LA DOULEUR INTERMITTENTE peut manifester les deux types suivants:
• une durée identique pour chaque survenue de douleur
• des durées variables à chaque survenue de douleur.
Le caractère "QUALITE OU SENSATION PARTICULIERE" peut être ressenti "cliniquement' selon divers modes:
-
• une douleur "DOULEUR" i.e. une douleur qui fait mal mais sans autre caractère à cette douleur que celui de faire mal,
ou encore
• une douleur
• "BRULURE",
• "PICOTEMENT",
• "ENGOURDISSEMENT",ou encore
• une douleur avec sensation
• D'ECRASEMENT,
• DE PRESSION,
• DE QUELQUE CHOSE QUI SERRE
CONSTAMMENT / PAR EPISODES BREFS
• DE QUELQUE CHOSE QUI POUSSE
CONSTAMMENT / PAR EPISODES BREFSou encore
• une douleur avec sensation
• D'ELANCEMENT
• DE TORSIONS,
• DE COLIQUES,
• DE CRAMPES,
• DE DECHIREMENTS,
• DE TIRAILLEMENTS,
• DE PINCEMENTS.
Aucune information "anatomo-physiologique" ni "pathophysiologique" n'est cette fois disponible à partir de cette façon de classifier. Cette classification ne permet pas plus que la précédente d'orienter la gestion analgésique particulièrement en regard du choix parmi l'arsenal des analgésiques et des co-analgésiques.
111 - Une sous-classification "pathophysiologique" propre aux douleurs neurogènes
Une nomenclature tentant de décrire avec des termes plus génériques un certain caractère "pathophysiologique" propre aux douleurs neurogènes peut aussi être considérée. Cette nomenclature permet alors d'envisager une classification basée sur ce même caractère, celle-ci peut alors se ramener à quatre sous-types de douleurs neurogènes:
-
les douleurs ressenties comme étant de la douleur sans plus i.e. des douleurs "douleur" exprimées en terme de classification comme étant des douleurs "simples",
-
les douleurs ressenties comme des dysesthésies ou paresthésies exprimées en terme de classification comme étant des douleurs "accompagnées"
-
les douleurs survenant par épisodes soudains et pouvant être de durée variable mais pratiquement toujours d'intensité maximale exprimées en terme de classification comme étant des douleurs "paroxystiques" ou "en salves"
et
-
les douleurs complexes définies sous le vocable de Syndrome douloureux régional complexe qui étaient autrefois appelées dystrophies sympathiques réflexes / causalgie. (Voir: LA MULTI-CONVERGENCE ET SES REPERCUSSIONS: LE DECLENCHEMENT D'UNE REPONSE SYMPATHIQUE REFLEXE HYPERACTIVE). Une portion de ces douleurs peut subir "une participation et un rehaussement" par le système nerveux autonome sympathique alors qu'une autre portion est exempte de cette composante. Ces douleurs sont maintenant appelées "Douleurs régionales complexes avec participation sympathique (Sympathetically Maintained Pain) ou sans participation sympathique". Il ne sera pas fait mention explicitement de ces douleurs dans les présents manuels étant donné la rareté de ce mode de présentation dans les contextes de soins palliatifs.
Le détail de chacune de ces présentations cliniques fera l'objet d'une plus longue discussion ultérieurement dans le présent manuel.
Bien qu'il manque encore certaines informations "cliniques" avec cette classification, particulièrement sur les façons dont les douleurs peuvent être ressenties (constance, intensité, caractère particulier ressenti ... ), il devient pourtant possible enfin d'utiliser une classification pour aider à orienter la gestion analgésique. Cette contribution s'exerce particulièrement en regard des choix parmi l'arsenal des analgésiques et des co-analgésiques comme il en sera traité ultérieurement dans les manuel III et IV portant sur la gestion analgésique avec les co-analgésiques et les opiacés. Une portion seulement des douleurs physiques sont cependant incluses dans cette sous-classification, la portion nociceptive y est totalement absente.
112 - Une classification hybride "simplifiée" des douleurs physiques
Les six manuels de la présente série "Ces personnes qui ont mal" propose une classification simplifiée des douleurs physiques telles qu'elles sont rencontrées dans un contexte de soins palliatifs oncologiques. Cette classification "simplifiée" repose sur une combinaison de quatre entités, anatomiques, physiologiques, pathologiques et cliniques. Elle ne possède pas d'homogénéité et se trouve donc être un hybride de ces différentes entités. Cette façon de classifier les douleurs ne se retrouvent pas comme telle dans la littérature portant sur la douleur, elle est discutable en raison de son manque d'homogénéité mais il n'en demeure pas moins qu'elle a été l'outil de travail depuis le milieu des années quatre-vingt dans un contexte des soins palliatifs en milieu hospitalier universitaire et qu'elle a toujours bien servi la cause des personnes qui avaient mal.
Nous offrons de la partager, conscient des ses limites mais en même temps assuré qu'elle peut aider plus d'un clinicien dans ses interventions auprès des personnes qui ont mal. Elle offre comme autre avantage, en plus de sa facilité de mémorisation, de pouvoir enfin guider la gestion analgésique, particulièrement en regard du choix parmi l'arsenal des analgésiques et des co-analgésiques et cela pour l'ensemble des douleurs nociceptives et des douleurs neurogènes. Un organigramme reposant sur cette classification et intégrant les indications pharmacologiques est proposé dans les Manuels III et IV de cette série.
Le contenu des six manuels de cette série sera dorénavant basé sur cette classification hybride.
La classification "simplifiée" regroupant les quatre volets "anatomo-patho-physiologique" et "clinique" offre la vision suivante.
Les douleurs physiques se divisent en deux grandes familles:
-
les douleurs NOCICEPTIVES
et - les douleurs NEUROGENES.
Chaque grande catégorie ou famille de douleur sera discutée plus en détail dans ce premier manuel. Chacune de ces deux grandes familles de douleurs se subdivise à son tour.
La douleur NOCICEPTIVE comprend deux sous-types anatomique:
-
la douleur somatique
et -
la douleur viscérale.
La douleur nociceptive VISCERALE se subdivise à son tour sur le plan clinique en deux sous-types:
-
la douleur continue ou constante
et -
la douleur colique ou spastique.
La douleur NEUROGENE, quant à elle, se divise en quatre différents sous-types cliniques
- la douleur "simple"
- la douleur "accompagnée" d'un caractère quelconque et dont l'intensité varie de paresthésie jusqu'à dysesthésie,
-
la douleur "paroxystique" ou "en salves"
et finalement en un quatrième sous-type plus complexe - le Syndrome douloureux régional complexe (Complex Regional Pain Syndrome) qui ne fait pas l'objet d'une explication détaillée dans le présent document mais dont il sera tenu compte.
Ce dernier type de douleur a porté différents noms: dystrophie sympathique réflexe, causalgie et bien d'autres. Tout récemment (International Association for the Study of Pain - IASP - 1994), le Syndrome douloureux régional complexe (Complex Regional Pain Syndrome), considéré pendant longtemps comme étant toujours sous l'influence du système sympathique, a été subdivisé en deux entités:
-
-
avec "participation et rehaussement" du système nerveux autonome sympathique ("Sympathetically Maintained Pain")
et - sans "participation ni le rehaussement" du système nerveux autonome sympathique ("Sympathetically Independant Pain").
-
avec "participation et rehaussement" du système nerveux autonome sympathique ("Sympathetically Maintained Pain")
Dans les documents qui suivent, il sera surtout fait référence au Syndrome douloureux régional complexe avec "participation et rehaussement" du système nerveux autonome sympathique (Douleur avec participation sympathique / Sympathetically Maintained Pain).
Nous souhaitons que cette classification "pratique et simple" puisse devenir un outil précieux pour le clinicien lui permettant d'avoir une vue d'ensemble sur les différentes douleurs ressenties tout en lui offrant en même temps une vision sur les différents choix "thérapeutiques" pharmacologiques appartenant à chaque sous-entité.
113 - La douleur nociceptive: son origine pathophysiologique
La douleur nociceptive tire son nom du fait qu'elle origine de la stimulation de récepteurs qui transmettent au cerveau des signaux interprétés comme étant de la douleur. Ces "récepteurs de la douleur", plus adéquatement identifiés comme nocicepteurs, sont donc responsables de la première des deux grandes famille de douleurs soit la "douleur nociceptive". La façon dont ces signaux ou ces influx nociceptifs sont transmis au cerveau a déjà été présentée sommairement. (Voir: ACTIVATION PRIMAIRE / ACTIVATION SECONDAIRE / L'IMPRESSIONNANTE CASCADE DE RELAIS DANS LA TRANSMISSION DE L'INFLUX DOULOUREUX)
Ces nocicepteurs peuvent être situés en périphérie dans une structure "somatique" ou dans une structure "viscérale". En simplifiant beaucoup,
- les composantes "somatiques" comprennent la peau, les structures musculaires, articulaires et osseuses,
- les composantes "viscérales" (ou splanchniques) comprennent les vaisseaux sanguins et les organes internes, en fait toutes les structures qui sont innervées par le réseau autonome sympathique ou parasympathique.
Certaines notions sont rappelées brièvement concernant les nocicepteurs. (Voir: LES DIFFERENTS TYPES DE NOCICEPTEURS)
Peut-être parmi les premières notions à rappeler est celle que des nocicepteurs sont presque partout présents dans l'organisme. On peut ainsi comprendre qu'il soit "si facile" de ressentir de la douleur ou plutôt de provoquer celle-ci.
Il existe différents sous-types de nocicepteurs qui sont activés par différents stimuli "douloureux". Certains ne répondent sélectivement qu'à une seule sorte de stimulus, d'autres répondent à divers types de stimuli. De façon succincte, les nocicepteurs peuvent être "activés" par des stimuli mécaniques, thermiques ou chimiques. Certains de ces récepteurs sont activés par de très faibles intensité de stimulation alors que d'autres nécessitent de fortes intensités avant d'être activés.
Il existe quatre principaux types de nocicepteurs:
- les mécanorécepteurs.
- les thermorécepteurs.
- les récepteurs mécanothermiques.
- les récepteurs polymodaux qui sont de très loin les plus abondants de tous les nocicepteurs.
La fonction des nocicepteurs, depuis l'apparition de la vie, a toujours été de prévenir la détérioration d'une structure en signalant sa blessure par une alarme "douleur". Certains de ces états sont bien connus. En effet, personne n'ignore que la plaie consécutive à une chirurgie sera douloureuse pendant un certain temps. L'irritation cutanée parfois présente dans un foyer traité par radiothérapie, les coups de soleil, l'entorse de la cheville, constituent autant d'exemples d'un même mécanisme inflammatoire occasionnant la stimulation des nocicepteurs.
Avec le temps, le système nociceptif s'est raffiné mais s'est aussi complexifié avec un prix à payer pour posséder autant d'avertisseurs partout dans l'organisme et un réseau aussi sophistiqué: celui de voir apparaître des douleurs diverses, à différents sites, parfois de façon prolongée, lorsqu'une maladie ou une condition quelconque agressent ce réseau.
114 - La douleur nociceptive: son origine clinique
Dans le contexte des soins palliatifs "oncologiques", la stimulation d'un des différents types de nocicepteurs peut résulter de différentes conditions pathologiques ou de différents contextes thérapeutiques. Ainsi, les nocicepteurs peuvent être stimulés
-
par l'envahissement tumoral d'une région ou d'un organe, envahissement qui peut ainsi causer une compression, une infiltration ou encore une destruction d'un certain nombre de neurones nociceptifs,
- par des "agressions tissulaires sur le réseau nerveux" résultant d'un traitement (chimiothérapie, chirurgie, radiothérapie).
115 - La douleur nociceptive: les substances inflammatoires et la sensibilisation
Peu importe le processus sous-jacent, l'aboutissement final est toujours le même. Il peut être compris comme le déclenchement de mécanismes inflammatoires entraînant la production de nombreuses substances chimiques ayant en commun la capacité de stimuler les nocicepteurs, on les dit substances algogènes. Parmi ces subtances on retrouve
- les prostaglandines
de même que les substances suivante:
- bradykinine,
- sérotonine,
- acétylcholine,
- ATP,
- substance P,
- histamine,
- leukotriène B4 (LKT-B4),
- interleukine 1-alpha et 1-bêta (IL-1a et 1b),
- "tumor necrosis factor"-alpha (TNF-alpha))
(Voir: L'ACTIVATION "PRIMAIRE").
Ces substances inflammatoires exercent leur action sur les milliers voire les millions de nocicepteurs siégeant dans la région touchée en les sensibilisant ou en les activant.
Le phénomène de sensibilisation des nocicepteurs correspond en fait à un abaissement du seuil d'activation des nocicepteurs, i.e. à une plus grande facilité à produire un influx mais sans créer d'influx cependant. Plus le seuil s'abaisse, plus la fréquence d'activation augmente parce qu'il est plus facile à ce moment de produire un influx et donc plus s'accroît le nombre de messages douloureux atteignant le cerveau. On pourrait comparer l'effet des nombreuses substances algogènes responsables d'une sensibilisation accrue des récepteurs de la douleur à la fatigue qui a pour effet de nous rendre, nous les humains, plus sensibles à tout irritant, aussi minime soit-il. En fait, la fatigue pourrait être comprise comme un élément "sensibilisateur" de notre patience! Le phénomène d'activation des nocicepteurs correspond à la production d'un influx.
Plus la production et le déversement des nombreuses substances algogènes vont prendre d'importance, plus les douleurs d'origine périphérique vont s'amplifier. Cette amplification de la stimulation des nocicepteurs va finir par se manifester en périphérie et cette manifestation se fait sous la forme d'une hyperalgésie.
Lorsque l'accumulation des substances "algogènes" prend de large proportion, les récepteurs non nociceptifs commencent alors à subir les mêmes effets que les nocicepteurs à savoir une sensibilisation et une activation, ils commencent donc à participer à la production de messages douloureux. Ainsi les fibres A bêta branchées à des récepteurs liés aux stimulations cutanées complexe telles
- le sens de la vibration,
- la discrimination tactile,
- le sens de la position,
- le sens de vibration,
- le degré de pression,
commencent alors à émettre des fréquences de décharges (firing rate) comparables aux fibres nociceptives. La deuxième portion de l'amplification de la douleur d'origine périphérique se révèle cliniquement alors avec l'allodynie. Les seuils d'activation des récepteurs non nociceptifs sont à ce point altérés et ces mêmes récepteurs sont à ce point soumis à des stimulations par la soupe de substances algogènes que leur activation provoque maintenant de la douleur. Ainsi le moindre effleurement, le moindre contact avec une région cutanée dans l'environnement douloureux, le moindre courant d'air provoque des douleurs affreuses. On parle alors de ces transformations en terme de "conversion phénotypique" des récepteurs non nociceptifs et des fibres non-nociceptives A delta et A bêta "branchées" à ces récepteurs.
En fait, cette conversion se manifeste par des transformations telles au niveau de la biochimie des fibres A bêta qu'elles se mettent alors à produire et libérer des neurotransmetteurs excitateurs tels de la substance P. C'est alors la substance P cette fois en provenance des boutons pré-synaptiques des fibres A bêta qui vient alors activer les fibres centrales convergentes (WDR). Ainsi apparaît l'allodynie dans son sens le plus pur! Cette particiaption des fibres A bêta à l'allodynie est indéniable puisque le blocage des fibres A bêta (en laboratoire) réduit de façon considérable l'allodynie. Dès lors que les substances algogènes ont exercé de tels effets autant sur les nocicepteurs que sur les récepteurs non-nociceptifs se produit un autre événement électrique avec ses répercussions cliniques. Toute stimulation autant douloureuse que non douloureuse provoque alors une longue persistance des décharges électriques qui fait en sorte que de la douleur continue à être ressentie plusieurs minutes après l'arrêt de toute stimulation.
Le phénomène de "conversion phénotypique" des fibres A bêta peut tout aussi bien s'observer dans les cas d'agression neurogène causée par un processus néoplasique, le point de départ de l'hyperactivation se trouvant alors sur les fibres nociceptives et sur les fibres non-nociceptives A bêta. Il n'est pas rare en effet d'observer de l'allodynie dans les cas de neuropathies, plexopathies ou radiculopathies découlant d'un envahissement tumoral.
Par ailleurs, à la suite des agressions intenses causées
- soit directement sur les nocicepteurs et les autres récepteurs non-nociceptifs par une importante accumulation de substances algogènes,
- soit directement sur les fibres nociceptives et non-nociceptives A delta et A bêta par un environnement tumoral,
apparaissent des ramifications ou des projections "poussant" à partir des boutons présynaptiques de ces fibres. Ces projections s'observent particulièrement dans les couches I et II de la corne postérieure où elles peuvent alors se "brancher" directement sur les neurones "nociceptif-spécifiques" auxquels elles n'ont pas accès dans l'ordre normal physiologique des choses puisqu'elles utilisent préférablement différents interneurones comme intermédiaires de branchement. Ce faisant, elles peuvent activer directement ces neurones centraux nociceptifs. En même temps elles échappent aux mécanismes de contrôles inhibiteurs pré-synaptiques,
- puisqu'ils les terminaisons "présynaptiques" de ces projections nouvelles ne sont pas munis d'interneurones inhibiteurs branchés
- que les terminaisons présynaptiques de ces projections ne développent pas de récepteurs "inhibiteurs" à leur surface.
La résultante finale est toujours la même soit de produire une allodynie qui échappent de plus en plus à toute intervention modulatrice inhibitrice qu'elle soit physiologique par les faisceaux inhibiteurs descendants ou purement pharmacologique.
A cette amplification périphérique vient s'ajouter de façon synchrone la participation des NMDA qui ajoute encore un autre facteur d'amplification mais cette fois-ci au niveau central.
Etrange adaptation s'il en est une puisque ... plus de douleur provoque encore plus de douleur!
Ces changements nous permettent d'imaginer qu'il pourrait rester de la place pour des interventions à visée analgésique dans la portion post-synaptique du réseau nociceptif aux étages des cornes postérieures, interventions qu'il reste pour le moment à découvrir en bonne partie.
116 - La douleur nociceptive: des nocicepteurs partout
En marge de ces explications, il est important de préciser que ces nocicepteurs sont presque partout présents dans l'organisme. On peut ainsi comprendre qu'il soit "si facile" de ressentir de la douleur ou plutôt de provoquer celle-ci.
La fonction de ces récepteurs, depuis l'apparition de la vie, a été de prévenir la détérioration d'une structure en signalant sa blessure par une alarme "douleur". Cependant, il y a un prix à payer pour posséder autant d'avertisseurs partout dans l'organisme: c'est celui de voir apparaître diverses douleurs, parfois de façon prolongée, à différents sites, lorsqu'une maladie ou une condition quelconque les stimulent.
Certains de ces états sont bien connus. En effet, personne n'ignore que la plaie consécutive à une chirurgie sera douloureuse pendant un certain temps.
L'irritation cutanée parfois présente dans un foyer traité par radiothérapie, les coups de soleil, l'entorse de la cheville, constituent d'autres exemples d'un même mécanisme occasionnant la stimulation des récepteurs de la douleur.
117 - La douleur nociceptive: réseau nerveux intact
Il va sans dire que pour que la stimulation du nocicepteur soit ressentie comme de la douleur "nociceptive", il faut absolument que tout le réseau neurologique conduisant cet influx douloureux à partir du récepteur, et ce, jusqu'au cortex cérébral sensitif soit absolument intact sur les plans structurel et fonctionnel. Les douleurs nociceptives peuvent en fait être comprises comme étant des douleurs reposant sur une physiologie et un réseau normaux ce qui fait que les messages nociceptifs arrivant au cerveau respectent une architecture que l'on pourrait aussi qualifier de normale. Lorsque des transformations apparaissent dans le réseau nociceptif ou lorsque des agressions sont produites sur ce même réseau, le cerveau commence à recevoir des informations erronées.
Ces informations "erronées" sont justement le propre de la deuxième grande famille de douleur: les douleurs neurogènes.
118 - La douleur nociceptive somatique
La douleur nociceptive somatique est causée par la stimulation des récepteurs de la douleur, i.e. des nocicepteurs situés dans les structures somatiques (structures musculaires, osseuses et articulaires). Ces nocicepteurs ont bien souvent été sensibilisés par différentes substances chimiques au point de devenir très facilement "irritables". Ils réagissent alors au moindre stimulus en "s'activant" plus rapidement qu'habituellement (Voir: LA DOULEUR NOCICEPTIVE: LES SUBSTANCES INFLAMMATOIRES, LA SENSIBILISATION) ce qui envoie vers le cerveau des influx "douloureux". Le mot-clé, dans le cas des douleurs nociceptives somatiques est "substances chimiques". Ce sera aussi le mot-clé de la thérapeutique avec les anti-inflammatoires non stéroïdiens comme substances préférentielles.
Parmi toutes les douleurs nociceptives somatiques, il en est un type que le contexte oncologique fournit en abondance, c'est celui des douleurs par métastases osseuses. Il est à noter que les douleurs par métastases osseuses ne sont présentes que lorsque l'envahissement tumoral est parvenu au périoste i.e. là où se trouvent les nocicepteurs. Les douleurs provenant des métastases osseuses sont attribuables principalement à deux grandes sortes de mécanismes:
- Des mécanismes chimiques.
Ces mécanismes sont exercés par la kyrielle de substances inflammatoires algogènes (PG, Bradykinine, sP, Histamine, Sérotonine, Leukotriène, H+, K+) découlant des dommages cellulaires et de la destruction du milieu produits par l'agression tumorale. Ces substances inflammatoires algogènes ont alors pour effet de sensibiliser et/ou d'activer les nocicepteurs présents en abondance dans le périoste. Par ailleurs, l'importante induction ostéoclastique exercée par les cellules tumorales et responsable de l'intense activité "destructrice ou lytique" au niveau de la substance osseuse vient ajouter une plus grande quantité de substances inflammatoires algogènes à l'abondance déjà produite. Par ailleurs, les cellules tumorales libèrent à leur tour plusieurs substances inflammatoires algogènes, le tout contribuant à une plus grande sensibilisation et/ou activation des nombreux nocicepteurs présents dans le périoste. (Voir: LE CARACTERE "AGRESSANT" DES DIFFERENTS STIMULI "DOULOUREUX" ET LA PRODUCTION DE SUBSTANCES INFLAMMATOIRES)
Il se pourrait aussi que la prolifération tumorale une fois arrivée au périoste envahisse les micro-structures nerveuses au pourtour de l'os ajoutant de ce fait une contribution neurogène aux douleurs nociceptives déjà importante.
- Des mécanismes mécaniques
Ces mécanismes découlent de la distorsion du périoste créée par la prolifération tumorale. La prolifération tumorale aboutit à une expansion tumorale qui provoque alors de l'étirement sur le périoste. De plus, les distorsions périostés et la réduction de l'épaisseur périostée dans les zones lytiques entraînent une augmentation de pression mécanique dans ces zones. Or le périoste possède aussi des nocicepteurs sensibles aux stimulations mécaniques. Par ailleurs, il est aussi possible que l'envahissement périosté soit responsable de microfractures périostées multiples qu'il est impossible de diagnostiquer par les moyens d'investigation actuels mais qui contribuent à la fois aux stimulations mécaniques et aux stimulations chimiques par le biais des réactions inflammatoires induites par les tentatives de réparation multifocales.
119 - La douleur nociceptive somatique: sa fréquence
La douleur nociceptive somatique est le type de douleur le plus fréquent chez les personnes atteintes de cancer.
Les douleurs provoquées par les métastases osseuses en constituent l'exemple le plus classique. Sachant qu'il existe une concentration très élevée de nocicepteurs dans le périoste, on peut facilement comprendre que toute croissance néoplasique dans la région du périoste soit susceptible d'entraîner des douleurs osseuses.
Or il s'avère que les cancers les plus fréquents ont une propension à se disséminer dans les tissus osseux pour produire des métastases osseuses. Parmi ces cancers, on retrouvent notamment les cancers du sein, du poumon, de l'estomac, du colon et du rectum, de la prostate, du col utérin, de la thyroïde et des reins.
Inutile d'insister davantage. Les douleurs dues aux métastases osseuses qui sont en fait des douleurs nociceptives de type somatique sont très fréquentes, comme on peut le comprendre facilement.
Il existe de nombreux autres exemples de douleurs somatiques, plus faciles à identifier une fois que l'on a bien compris les mécanismes sous-tendant ce type de douleur soient la sensibilisation et l'activation des nocicepteurs par la présence de substances "inflammatoires" dites algogènes.
120 - La douleur nociceptive somatique: des exemples
De nombreuses situations entraînent l'apparition de douleurs nociceptives somatiques, à titre d'exemple:
- les métastases osseuses,
- les coups de soleil,
- la plaie postopératoire immédiate,
- l'entorse malléolaire ou celle de toute autre articulation,
- une tendinite / bursite.
121 - La douleur nociceptive somatique: le circuit nerveux somatique
La douleur nociceptive somatique est celle qui est ressentie dans la peau, les tissus sous-cutanés profonds et les structures musculaires, osseuses et articulaires.
Cette douleur est transmise par les fibres nerveuses du réseau nociceptif somatique (C et A delta). C'est donc dire qu'à partir de son point d'origine, cette douleur, est acheminée vers la moelle épinière par les nerfs périphériques somatiques. Les nerfs somatiques périphériques sont ceux que l'on retrouve dans la peau, les membres; on retrouve aussi une portion somatique parmi un certain nombre de nerfs crâniens. Le nerf radial ou médian dans le membre supérieur, le nerf sciatique ou fémoral dans le membre inférieur sont des exemples de nerfs somatiques.
Ces nerfs de même que tous les autres nerfs périphériques sont disposés suivant une configuration anatomique définissant des dermatomes. Cette configuration permet à chaque région du corps de véhiculer les informations douloureuses tout comme les autres informations sensitives vers une racine particulière qui devient prédominante pour une région anatomique donnée. Par exemple, les messages sensitifs en provenance de la région de l'épaule passent principalement par la racine C5, alors que ceux qui viennent de la partie antérieure de la cuisse voyagent surtout par la racine L2.
Avant leur entrée dans la moelle épinière par les racines, les nerfs périphériques des étages cervicales, lombaires et sacrées du système somatique convergent vers différents plexus somatiques dont ils sont tributaires (cervical, brachial, lombaire et sacré). Ensuite, ces nerfs périphériques pénètrent finalementdans la moelle épinière par les racines .
L'étalement des principaux plexus somatiques se fait de la façon suivante:
- le plexus cervical s'étend des racines C2 à C4
- le plexus brachial s'étend des racines C5 à D1
- le plexus lombaire s'étend des racines L2 à L4 avec des variantes de L1 à L4
- le plexus lombo-sacré s'étend des racines L4 à S5.
122 - Le circuit nerveux somatique: la branche postérieure (posterior rami) de la racine postérieure et les douleurs à distance
Chaque racine (aussi appelée nerf spinal) fait son entrée dans le canal médullaire par une ouverture latérale entre deux vertèbres adjacentes à laquelle on réfère comme étant un trou de conjugaison ou un foramen. Une fois à l'intérieur du canal médullaire, la racine (ou manchon radiculaire ou nerf spinal) se subdivise en racine postérieure et antérieure. La racine postérieure contient les différents fibres de la sensibilité incluant bien sûr les fibres nociceptives. Ces fibres présentent un renflement au niveau du trou de conjugaison correspondant à leur noyau cellulaire. La racine antérieure contient les fibres de la motricité et celles du réseau autonome sympathique.
Immédiatement avant son entrée dans le trou de conjugaison, la racine présente des embranchements qui sont de deux types. Les embranchements
- antérieurs fournissent les innervations autonomes sympathiques pour la chaîne sympathique et proviennent en fait de la racine antérieure,
-
postérieurs (posterior rami) du nerf spinal qui sont en fait formés d'une branche postérieure unique amplement ramifié cependant reçoivent les fibres nociceptives somatiques innervant les différentes structures suivantes présentes à la région para-rachidienne (ou para-vertébrale)
- · la peau,
- · les muscles intrinsèques de la colonne vertébrale,
- · les articulations de la colonne, i.e. les articulations inter-apophysaires,
- · les ligaments sus-épineux et inter-épineux.
et vont donc faire leur entrée dans la moelle par la racine postérieure.
Cette structure anatomique, la branche postérieure, se retrouve à toutes les étages du système radiculaire somatique. Les branches postérieures débutent avec les premiers étages des racines cervicales et sont présentes jusqu'aux derniers nerfs sacrés, on les retrouve en fait du vertex au coccyx. Les branches postérieures gauche et droite sont en fait de longs prolongements qui viennent se terminer en de nombreux sous-rameaux au niveau des plans cutanés et sous-cutanés des régions postérieures cervicales, dorsales, lombaires, sacrées et coccygéennes. Aux étages dorsales inférieures et lombaires supérieures, les branches postérieures gauche et droite s'étendent sur plusieurs étages et prennent donc origine beaucoup plus bas qu'à l'étage où elles vont faire leur entrée.
A titre d'exemple, les champs récepteurs (i.e. l'innervation sensitive) de la région lombaire et para-lombaire basse et de même que de la région fessière haute particulièrement celle chevauchant la région de la crête iliaque postérieure sont véhiculés par les branches postérieures arrivant aux racines L1 et L2. Ces racines reçoivent donc des influx somatiques sensitifs et nociceptifs de régions qui sont relativement éloignées, anatomiquement, de la région qui pourrait sembler les concerner.
Ainsi, une douleur ressentie à la région de la crête iliaque postérieure et à la région sacro-iliaque est susceptible de provenir en fait d'une irritation, voire d'une lésion du tissu nerveux, par un processus pathologique situé au niveau de la région D12 - L1. En contexte oncologique, une douleur dans cette région est souvent "trompeuse". Elle est attribuée de prime abord à une atteinte osseuse de la colonne lombaire basse, de la région sacro-iliaque ou encore directement du sacrum supérieur. L'investigation radiologique est alors déroutante puisque négative et pourtant l'examen clinique démontre hors de tout doute une ou des douleurs dans les régions citées. En fait, en contexte oncologique, les structures osseuses les plus probablement atteintes sont au niveau D11, D12, L1 ou à la limite L2 et ces atteintes néoplasiques affectent la branche postérieure sans toucher la ou les racines à ces mêmes niveaux. Si un traitement de radiothérapie s'impose, c'est au niveau de D11, D12, L1 ou à la limite L2 qu'il devra être fait, pas au niveau où la douleur est ressentie. Ce type de présentation n'est en fait rien d'autre qu'une douleur irradiée puisque les fibres périphériques sont directement affectées. (Voir: EPARPILLEMENT MULTI-ETAGE, MULTI-CONVERGENCE, DOULEUR IRRADIEE ET DOULEUR REFEREE)
Voilà de quoi tromper, pour plus d'une raison, l'évaluation faite pour des douleurs ressenties dans les régions pararachidiennes (ou paravertébrales).
Mais il y a pire encore pour tromper l'évaluation, puisque des anastomoses entre les branches postérieures de différents étages sont fréquentes. Cela signifie une plus large dispersion de l'anatomie "déjà confondante" de ces branches. Ainsi, la région fessière pourrait carrément être innervée par une branche en provenance de D10 à l'occasion ce qui pourrait confondre plus d'un clinicien "non-averti".
Il est donc important de se rappeler que la zone où de la douleur est éprouvée est toujours déterminée, autant pour le cas des douleurs irradiées que référées, par la racine "préférentielle" à travers laquelle le message nociceptif pénètre dans la moelle épinière et que des informations à la fois somatiques et viscérales peuvent se retrouver dans cette racine.
Ces notions ont déjà fait l'objet de discussions aux chapitres LE SYSTEME DE TRANSPORT DES INFLUX NOCICEPTIFS PERIPHERIQUES: L'EPARPILLEMENT MULTI-ETAGE et EPARPILLEMENT MULTI-ETAGE, MULTI-CONVERGENCE, DOULEUR IRRADIEE ET DOULEUR REFEREE. Par ailleurs, ces notions seront rediscutées brièvement à la section portant sur les douleurs neurogènes.
123 - La douleur nociceptive somatique: son caractère clinique
Sur le plana clinique, la douleur nociceptive somatique est assez bien localisée. Pour ce qui est de son caractère "QUALITE OU SENSATION PARTICULIERE", cette douleur est habituellement ressentie comme une "douleur qui fait mal", parfois aussi comme une brulûre. La personne qui l'éprouve peut, avec une assez grande précision habituellement, situer l'endroit où la douleur est présente et ressentie.
Ainsi, par exemple, il sera possible pour le patient porteur d'une métastase située dans la partie supérieure de l'humérus, de bien circonscrire la zone où la douleur est ressentie. A l'examen physique, le siège de la douleur pourra souvent être déterminé avec encore plus de précision, souvent au centimètre près, car cette douleur est intensément exacerbée par une pression du bout du doigt alors que la même pression à quelques centimètres de la lésion ne provoque pas de douleurs. Il est même souvent possible, de diagnostiquer et de localiser une métastase osseuse présumée, avant le scan osseux, par simple pression du doigt.
Il en va tout autrement pour la douleur viscérale dont nous discuterons plus loin.
La douleur nociceptive somatique correspond à la douleur "épicritique", terme utilisé depuis 1920 pour décrire des douleurs bien localisées en raison d'une bonne discrimination de l'information nociceptive.
124 - La douleur nociceptive somatique: une description schématique
Enfin, la douleur nociceptive somatique est généralement décrite, par la personne atteinte, comme une douleur constante, "toujours là", profonde et agaçante ou "tannante". Il est moins fréquent que cette douleur soit intermittente mais elle peut l'être tout aussi bien.
Lorsque constante, le caractère de constance peut cependant se présenter de trois façons:
- une douleur constante avec une intensité constante,
- une douleur constante avec certaines variations dans l'intensité,
- une douleur constante avec beaucoup de variations dans l'intensité.
-
-
Lorsqu'elles sont intermittentes, le caractère d'intermittence peut se présenter de cinq façons selon les paramètres du début, de la durée et de l'intensité:
- à son début, la douleur peut survenir subitement,
- à son début, la douleur peut survenir progressivement,
- pour chaque épisode, la douleur peut avoir une durée et une intensité semblables,
- pour chaque épisode, la douleur peut avoir une durée semblable et une intensité différente,
- pour chaque épisode, la douleur peut avoir une durée différente et une intensité semblable.
125 - La douleur nociceptive viscérale: son origine pathophysiologique
La douleur nociceptive viscérale est déclenchée par l'activation des nocicepteurs siégeant à l'intérieur ou au pourtour des viscères ou dans les parois des vaisseaux sanguins et qui parfois ont été préalablement sensibilisés. Malgré une définition paraissant ressembler à la douleur nociceptive somatique, la douleur nociceptive viscérale diffère considérablement de la douleur "somatique".
Le mot-clé, dans le cas de cette douleur, devient "étirement" avec ses nombreux synonymes: distension, spasme, traction, compression, torsion. Cet étirement cependant doit revêtir un des deux caractères suivants: étirement "soudain" ou étirement "extrêmement marqué". Un étirement prolongé et plus ou moins marqué ne provoquera pas de douleurs. Quelques-uns des stimuli mécaniques viscéraux les plus classiques incluent:
- une traction soudaine sur le mésentère,
- l'étirement marqué d'une séreuse,
- la compression d'un viscère causant secondairement une rapide distension,
- la distension marquée d'un organe creux.
Il apparaît donc que les nocicepteurs sensibles à l'étirement jouent un rôle particulièrement important dans ce type de douleur, parmi ceux-ci figurent les:
-
mécanorécepteurs
et - les récepteurs polymodaux.
D'autres stimuli jouent un rôle moins important. Des douleurs viscérales peuvent aussi être provoquées par des stimuli chimiques résultant d'une ischémie (infarctus du myocarde, colite ischémique) ou inflammation (diverticulite). Par contre, certains types de nocicepteurs paraissent être totalement absents des viscères, il est ainsi bien connu, depuis des décennies, que l'incision d'un viscère ou qu'une brûlure appliquée sur un viscère ne provoquent pas de douleur.
Certains viscères, tels le système biliaire, le colon et les uretères, possèdent des nocicepteurs à haut seuil d'activation qui ne répondent qu'aux stimuli douloureux intenses. La plupart des autres viscères possèdent des nocicepteurs qui réagissent à tous les degrés d'intensité de stimulations, à partir des stimulations non-douloureuses jusqu'aux stimulations franchement douloureuses.
Ainsi donc, dans le cas des douleurs viscérales, ce sont particulièrement des stimuli "d'étirement" qui produiront les signaux douloureux transmis vers le cerveau. Cependant, la présence d'un phénomène inflammatoire ou ischémique, au préalable, aura pour effet d'avoir "sensibilisé" les différents nocicepteurs viscéraux qui alors signaleront la douleur plus rapidement et de façon plus marquée. La réponse à ces stimulations se trouve alors augmentée de beaucoup. C'est le cas des douleurs urétérales causées par la présence d'un calcul qui, par phénomène irritatif, déclenchera une importante réaction inflammatoire dans la paroi. Des substances algogènes apparaîtront alors pour sensibiliser les nocicepteurs présents. Bien que les uretères soient surtout pourvus de nocicepteurs à haut seuil d'activation, la présence des substances algogènes fera en sorte que de la douleur sera rapidement ressentie à des distensions moindres que celles habituellement nécessaires pour provoquer des douleurs coliques.
En comparaison avec les afférences somatiques, les afférences viscérales nociceptives représentent moins de 10 % de toutes les afférences arrivant dans la corne postérieure. Cependant, une fois arrivée dans la corne postérieure, elles "s'éparpillent" de façon beaucoup plus étagée de sorte qu'ils finissent par rejoindre un nombre très élevé de neurones centraux. La douleur viscérale est donc non seulement différente de la douleur somatique sur le plan pathophysiololgique mais elle le sera tout autant sur le plan clinique comme il nous sera permis de le voir ultérieurement. Ainsi, le réseau viscéral nociceptif, quant à lui, n'est pas muni du raffinement proprioceptif que le réseau somatique possède, de plus, il "transmet" surtout par les fibres "C". Il contribue donc peu au faisceau néo-spinothalamique mais contribue beaucoup au faisceau paléo-spinothalamique. La douleur viscérale est donc fort mal localisable en bonne partie pour cette raison mais aussi à cause de l'éparpillement multi-étagé qui fait en sorte que des neurones nociceptifs centraux sur plusieurs étages sont soumis à une stimulation nociceptive viscérale. Finalement, l'homonculus est peu représentatif des structures viscérales et les raisons sont alors plus faciles à comprendre.
Les nocicepteurs viscéraux peuvent subir un étirement, voire un surétirement, de deux façons différentes. Ils peuvent être étirés:
-
de façon continue et persistante, comme dans le cas de métastases hépatiques présentes en abondance et responsables d'une hépatomégalie tellement volumineuse qu'elle devient une hépatalgie
ou encore - de façon soudaine et intense, comme dans le cas d'une colique néphrétique ou d'une occlusion intestinale.
126 - La douleur nociceptive viscérale: des nocicepteurs "mécanosensibles" presque partout
Des nocicepteurs des différents sous-types dont plusieurs répondant particulièrement à des stimuli mécaniques se retrouvent dans les viscères. On retrouve ainsi de tels récepeteurs dans les structures et sous-structures suivantes:
- les séreuses
les bourses,
la plèvre pariétale,
le péritoine,
le péricarde,
les capsules entourant les viscères, par exemple la capsule hépatique,
-
la paroi des vaisseaux, ce qui permet, en partie, de considérer les douleurs migraineuses comme étant des douleurs viscérales puisque les vaisseaux sont innervés par le réseau autonomique, ce qui distingue les structures somatiques des structures viscérales,
- la paroi et au pourtour des organes creux, notamment:
le canal cholédoque,
le canal pancréatique,
les uretères,
les trompes de Fallope,
la vessie,
le tube digestif supérieur et inférieur,
l'utérus.
Certains viscères semblent ne posséder aucun type de nocicepteurs dans leur parenchyme, notamment les poumons, le foie et les reins.
127 - La douleur nociceptive viscérale: son parcours dans le circuit nerveux autonome
Deux grandes divisions anatomiques ont été décrites pour les neurones nociceptifs, les neurones périphériques et les neurones centraux.
Les neurones périphériques pour leur part, qu'ils soient moteurs ou sensitifs, se subdivisent en deux sous-entités:
-
les neurones somatiques,
et -
les neurones viscéraux ou splanchniques.
Les neurones somatiques, en simplifiant beaucoup, apportent les afférences à partir des composantes "somatiques" i.e. la peau, les structures musculaires, osseuses et articulaires ou apportent les "efférences" vers ces mêmes composantes.
Les neurones viscéraux ou splanchniques, pour leur part, apportent les "afférences" à partir des composantes "viscérales" ou apportent les "efférences" vers ces mêmes composantes. Les neurones "viscéraux" moteurs sont en fait les composantes du système nerveux autonome (SNA) périphérique.
Le système nerveux autonome se compose, comme le système somatique, de nerfs et de plexus par lesquels les fibres cheminent. Classiquement, les nerfs et plexus du SNA sont représentés comme étant composés "exclusivement" de fibres motrices i.e. de fibres efférentes innervant des structures viscérales en périphérie. Cependant, les nerfs et plexus du SNA sont aussi composés de fibres nociceptives qui vont véhiculer les informations nociceptives provenant des viscères. Les nerfs et plexus du SNA comprennent donc:
-
des fibres motrices
et - des fibres sensitives donc des fibres nociceptives.
Les fibres motrices autonomiques se subdivisent en deux systèmes:
-
le système sympathique
et - le système parasympathique.
Ces deux systèmes, exercent, de façon complémentaire, chacun à leur manière, le contrôle moteur de nos différents viscères. A titre d'exemple, ils accélèrent ou ralentissent le coeur, augmentent ou diminuent les sécrétions gastriques, causent une vasodilatation ou une vasoconstriction des vaisseaux sanguins.
Dans le contexte nociceptif, le système nerveux autonome sympathique fournit même des "efférences" vers les nocicepteurs périphériques (Voir: LE SYSTEME "SYMPATHIQUE" ... QU'IL NE FALLAIT PAS OUBLIER!).
Ces deux systèmes vont aussi véhiculer des fibres nociceptives d'origine viscérale.
128 - La douleur nociceptive viscérale: le circuit nociceptif viscéral ou "splanchnique"
À partir des différents sous-types de récepteurs situés dans les viscères, la douleur viscérale est transportée par des afférences qui empruntent les voies du système nerveux autonome sympathique et parasympathique, avant d'arriver à la corne postérieure. Les voies du réseau sympathique transportent plus d'afférences nociceptives que les voies du réseau parasympathique.
Bien que véhiculées à travers les réseaux sympathiques ou parasympathiques, les fibres nociceptives d'origine viscérale possèdent, tout comme les fibres nociceptives d'origine somatique, leur corps cellulaire dans le ganglion dorsal puisqu'elles sont en fait toutes les deux des fibres nociceptives "pures" mais qui ont dû emprunter un réseau autre que le réseau somatique pour véhiculer leur information.
Le système digestif fournit un bel exemple du partage des deux réseaux autonomes, sympathique et parasympathique, par les fibres nociceptives viscérales qui y trouvent origine, ainsi:
- l'oesophage supérieur, l'estomac et la partie supérieure du duodénum transitent de façon prédominante via le réseau parasympathique (le nerf vague)
- la partie inférieure de l'oesophage et le grêle transitent de façon prédominante via le réseau sympathique (les chaînes ganglionnaires sympathiques et les nerfs splanchniques)
- le colon et le rectum utilisent surtout le réseau parasympathique.
Dans les faits, les influx nociceptifs viscéraux en provenance des viscères digestifs utilisent toujours les deux sous-réseaux avec chaque fois une prédominance pour un des deux.
Les influx nociceptifs en provenance des autres viscères (pex: système cardiovasculaire, système pulmonaire, système urogénital, système gynécologique, méninges) utilisent le réseau autonome de la même manière.
Le fait d'emprunter les circuits sympathique et parasympathique amène le réseau nociceptif viscéral à partager certaines propriétés ou caractéristiques appartiennent au réseau autonome et en même temps déroger du comportement des afférences nociceptives somatiques.
-
D'abord, les afférences nociceptives viscérales doivent respecter l'absence d'architecture bien organisée et logique que le système somatique présentait. Ainsi, les afférences nociceptives viscérales doivent se conformer aux longs trajets fortement intriqués dans lesquels figure un certain nombre de plexus viscéraux avant finalement de faire leur entrée par quelques racines avant de connaître le multi-étagement qui les caractérisent. Ces "entrées multiétagées" à la corne postérieure se font toujours loin du viscère pour lequel les afférences sont transportées, parfois même ces entrées se font étonnamment loin.
-
Par ailleurs, les fibres qui acheminent la douleur en provenance des viscères sont, de façon prédominante, des fibres C. Or, il n'existe pas de récepteurs pouvant offrir des informations adéquates sur la localisation des douleurs et qui utiliserait le réseau des fibres C. Ces fibres ne peuvent donc transmettre de message proprioceptif douloureux "valable". Il ne faudra donc jamais s'attendre à pouvoir cerner et situer avec précision la région où la douleur viscérale est ressentie comme il était possible de situer adéquatement les zones de douleurs dans le cas des douleurs somatiques. La douleur viscérale est donc toujours vague et imprécise dans sa localisation de par ses constituants physiologiques et anatomiques.
- En outre, comme les fibres transportant les douleurs viscérales doivent nécessairement cheminer par les chaînes ganglionnaires sympathiques pour une large part et comme le réseau sympathique transporte plus d'afférences nociceptives viscérales que le réseau parasympathique, il sera donc possible de bloquer partiellement ou complètement la douleur. Ces interventions se feront grâce à des techniques anesthésiques d'infiltration pratiquée soit au niveau d'un plexus viscéral visé (pex. le plexus coeliaque), soit au pourtour de la chaîne ganglionnaire sympathique par où passent les fibres nociceptives impliquées.
-
-
Finalement, le comportement des afférences nociceptives viscérales déroge encore du comportement des afférences nociceptives somatiques et cela à deux autres égards:
-
-
après leur entrée dans la moelle, les afférences nociceptives viscérales ont tendance à s'éparpiller sur 2 à 3 étages autant en cephalad qu'en caudad en utilisant le faisceau de Lissauer, pour faire un éparpillement total sur 5 à 6 étages au total, avant de faire synapse avec les neurones nociceptifs centraux alors que les afférences nociceptives somatiques limitent habituellement leurs incursions à 1 ou 2 étages plus haut et plus bas que leur point d'entrée. (Voir: L'EPARPILLEMENT MULTI-ETAGE: LA DIFFERENCE ENTRE LES AFFERENCES SOMATIQUES ET VISCERALES)
L'ascension des influx nociceptifs viscéraux se fait par deux faisceaux précédemment décrits, le faisceau paléo-spino-thalamique et le faisceau spino-réticulaire. Les afférences viscérales du faisceau spino-réticulaire se terminent à l'étage bulbaire dans la formation réticulée, tout comme le faisceau proprius, où le premier relais se fait vers d'autres structures supérieures.
- par ailleurs, bien que les influx nociceptifs empruntent les faisceaux paléo-spino-thalamique et spino-réticulaire dans leur transport vers les étages supérieurs, un troisième faisceau ascendant est spécifiquement dédié au transport des influx viscéraux, c'est le faisceau proprius (ou fasciculus proprius). Ce faisceau est aussi vieux que le paléo-spinothalamique, il est situé immédiatement au pourtour de la substance grise de la moelle. Les fibres nociceptives viscérales qui se dirigent vers ce faisceau vont s'éparpiller sur 1 à 2 étages autant en cephalad qu'en caudad plutôt que sur 2 à 3 étages, pour faire un éparpillement total sur 3 à 4 étages au total avant de faire synapse. Ce faisceau se termine au niveau du bulbe dans certains noyaux de la formation réticulée bulbaire et les influx d'origine viscérale sont alors acheminées vers les étages supérieures par des sous-faisceaux prenant origine dans la formation réticulée bulbaire.
Les douleurs d'origine viscérale peuvent donc faire leur ascension par trois circuits ascendants différents. Il est donc plus facile de comprendre pourquoi la technique de cordotomie (sectionner le spinothalamique latéral) est si peu efficace pour réduire les douleurs viscérales intenses.
129 - La douleur nociceptive viscérale: son caractère clinique
À la différence des douleurs nociceptives somatiques, les douleurs nociceptives viscérales sont généralement difficiles à localiser. Elles sont ressenties dans une certaine région dont les pourtours sont souvent imprécis et vagues.
Pourquoi le caractère vague, diffus (dull, vague) des douleurs viscérales?
Parce que
- les afférences nociceptives viscérales sont beaucoup moins importantes i.e. beaucoup moins nombreuses en comparaison des afférences nociceptives somatiques pour chaque étage d'entrée dans la moelle
- la dispersion des afférences nociceptives viscérales, "céphalad" et "caudad" se fait de façon beaucoup plus étalée que pour les afférences nociceptives somatiques.
-
les afférences nociceptives viscérales sont, dans une très large mesure, des fibres C en provenance de récepteurs polymodaux et donc dépourvues d'information proprioceptive.
(Voir LE SYSTEME DE TRANSPORT DES INFLUX NOCICEPTIFS PERIPHERIQUES: L'EPARPILLEMENT MULTI-ETAGE, LA DOULEUR NOCICEPTIVE VISCERALE: LE CIRCUIT NOCICEPTIF VISCERAL OU "SPLANCHNIQUE" et LA DOULEUR NOCICEPTIVE VISCERALE: SON ORIGINE PATHOPHYSIOLOGIQUE).
Par ailleurs, pour ce qui est du caractère "QUALITE OU SENSATION PARTICULIERE", ces douleurs sont souvent décrites comme profondes, souvent "en torsion" ou crampiformes ou encore coliques puisque, dans les faits, de nombreux viscères sont composés de muscles lisses qui exercent lors des manifestations cliniques de ces douleurs des contractions spastiques d'une étonnante force parfois. En fait, dès qu'un organe creux (cholédoque, canal pancréatique, uretère, intestin ...) subit une agression notable, de la douleur "colique" caractéristique risque de se manifester du moins dans les premiers jours de cette agression.
Tel que proposé dans la classification, la douleur viscérale peut également être constante plutôt que spastique ou colique. Un tel caractère se produit, dans un contexte de soins palliatifs oncologiques, quand la croissance tumorale dans un viscère ou à proximité d'un viscère entraîne une distension progressive et constante de ce même viscère. C'est le cas de l'hépatomégalie d'origine métastatique, précédemment proposée à titre d'exemple, qui occasionnera avec le temps une douleur dans la région hépatique. L'hépatomégalie sera devenue une hépatalgie lorsque la capsule hépatique aura été considérablement distendue.
La douleur nociceptive viscérale correspond au vieux terme de douleur "protopathique", terme utilisé depuis 1920, moins fréquemment de nos jours, pour décrire des douleurs difficiles à bien localiser en raison d'une absence d'information discriminative.
130 - La douleur nociceptive viscérale: ses aires de référence
Enfin, les douleurs viscérales sont très souvent ressenties au niveau de sites cutanés distants. On parle dans ces cas de douleurs référées. Il est plus facile de comprendre les raisons de ces douleurs référées lorsqu'on connaît les particularités anatomiques du système nerveux viscéral, spécialement l'éparpillement multi-étagé (Voir: LA DOULEUR NOCICEPTIVE VISCERALE: LE CIRCUIT NOCICEPTIF VISCERAL OU "SPLANCHNIQUE").
Cet éparpillement des influx nociceptifs d'origine viscérale entraîne un éloignement considérable entre le niveau d'entrée du message nociceptif dans la moelle épinière et le niveau où se situe l'organe atteint. De nouveau, il faut se rappeler que la zone de référence est déterminée par la racine "préférentielle" à travers laquelle le message nociceptif pénètre, racine dans laquelle se trouvent une abondance d'afférences d'origine somatique mêlées à un certain nombre d'afférences viscérales (Voir LE SYSTEME DE TRANSPORT DES INFLUX NOCICEPTIFS PERIPHERIQUES: L'EPARPILLEMENT MULTI-ETAGE).
Ainsi, une atteinte dans la région du diaphragme peut entraîner une douleur irradiant dans l'épaule, une atteinte de l'uretère distal peut causer une douleur référée à l'intérieur de la cuisse.
On peut même détecter des niveaux de sensibilité cutanée, grâce à la manoeuvre du pincé-roulé, dans les territoires cutanés touchés. Ceci témoigne soit du fait de l'activation à laquelle sont soumis les nocicepteurs des régions concernées, activation qui serait provoqué par un phénomène de boucle réflexe où les nocicepteurs seraient soumis à des stimulations efférentes, soit du fait que les fibres centrales nociceptives recevant les afférences viscérales seraient à ce point stimulées qu'elle répondraient à des manoeuvres qui ne sont pas d'une intensité nociceptive habituellement.
131 - La douleur nociceptive viscérale: une description schématique
Classiquement, les douleurs nociceptives viscérales sont décrites comme profondes, coliques ou "en torsion" et donc intermittentes mais, comme expliqué précédemment dans la classification, elles peuvent aussi être constantes. Tout dépend des caractéristiques pathophysiologiques sous-jacentes.
Lorsqu'elles sont coliques, elles sont par définition intermittentes puisque le caractère colique aura nécessairement une durée variable. Dans ces cas, le caractère d'intermittence peut se présenter de cinq façons selon les paramètres du début, de la durée et de l'intensité:
- à son début, la douleur peut survenir subitement,
- à son début, la douleur peut survenir progressivement,
- pour chaque épisode, la douleur peut avoir une durée et une intensité semblables,
- pour chaque épisode, la douleur peut avoir une durée semblable et une intensité différente,
- pour chaque épisode, la douleur peut avoir une durée différente et une intensité semblable.
Lorsque constantes, les douleurs viscérales sont généralement décrites, par la personne atteinte, comme des douleurs profondes, "envahissantes". A ce moment, le caractère de constance peut se présenter de trois façons:
- une douleur constante avec une intensité constante,
- une douleur constante avec certaines variations dans l'intensité,
- une douleur constante avec beaucoup de variations dans l'intensité.
132 - La douleur nociceptive viscérale: pathophysiologie des nausées / vomissements associés
Il est connu que lors de douleurs viscérales intenses, des nausées et des vomissements peuvent faire partie du tableau clinique.
Ces nausées et vomissements découlent d'une stimulation du centre du vomissement par les influx douloureux. Ces influx douloureux sont acheminés par la portion sensitive du nerf vague (Xe nerf crânien) vers le noyau vague sensitif ( le noyau ou tractus solitaire) au niveau du tronc cérébral. Ce noyau est situé à proximité du centre du vomissement, lui même situé à proximité du noyau moteur du vague. Le centre du vomissement transmet ainsi des influx vers le noyau moteur du vague qui lui, est responsable du déclenchement des mouvements de péristaltisme inversé et donc des vomissements.
133 - La douleur nociceptive viscérale: des exemples
Les douleurs viscérales existent sous deux formes: coliques et constantes.
En ce qui a trait aux douleurs coliques ou spastiques, quelques exemples sont proposés suivant le viscère touché:
- tube digestif et les douleurs d'occlusion intestinale,
- canal cholédoque et les douleurs de cholélithiases ou de colique biliaire,
- uretère et les douleurs de coliques néphrétiques,
- vessie et les douleurs de cystite aiguë.
Des exemples de douleurs viscérales constantes sont les suivantes:
- foie et multiples métastases hépatiques causant une hépatomégalie qui finalement devient hépatalgie,
- vessie et les douleurs causée par la distension d'une rétention urinaire marquée,
- oeil et le glaucome où les phénomènes de pression dépassent les phénomènes de distension.
D'autres exemples un peu moins évidents de prime abord appartiennent aussi aux douleurs viscérales:
- les douleurs migraineuses "pulsatiles" sont des douleurs viscérales puisque les vaisseaux ont le même type d'innervation que n'importe quel viscère i.e. une innervation autonome qui dans le réseau vasculaire est à dominance sympathique. Par ailleurs, les fibres nociceptives en provenance des nocicepteurs situés dans la paroi des vaisseaux sont des fibres C.
- l'otite moyenne aiguë, douleur tellement fréquente durant l'enfance, comporte des douleurs qui sont des deux types exposés précédemment. En effet l'inflammation intense du tympan provoque une douleur somatique, alors que l'accumulation de pus dans l'oreille moyenne finalement responsable de la distension du tympan provoque la composante viscérale. On doit se rappeler, en effet, que le vague (nerf X) innerve les structures de la gorge et de l'oreille interne et que certaines conditions ORL provoque des douleurs référées à l'oreille. La douleur viscérale l'emporte habituellement très nettement sur la douleur somatique présente au début à ce point qu'une rupture du tympan, donc une réduction de la distension, causera un soulagement presque "instantané" de cette douleur.
134 - La douleur neurogène ou neuropathique
Nous avons vu jusqu'à maintenant que la douleur nociceptive provient de la stimulation d'un nocicepteur "intact" et exige une totale intégrité c'est-à-dire une absence complète de toute forme de lésions dans le réseau nerveux qui sert à l'acheminement des influx douloureux, soit le réseau nociceptif et cela à partir du nocicepteur jusqu'au thalamus.
Il en est autrement pour la douleur neurogène qui ne trouve son existence qu'en présence de lésions sur les voies nerveuses nociceptives, ceci incluant les lésions touchant les nocicepteurs bien sûr. Il s'agit de la définition la plus fondamentale de la douleur neurogène ou neuropathique.
La douleur neurogène ne provient pas de la stimulation physiologique usuelle des nocicepteurs soit de l'activation par des substances inflammatoires algogènes ou de l'activation par des situations provoquant de l'étirement. Elle provient plutôt de dommages qui se sont produits "dans le câblage nerveux nociceptif". C'est à partir des régions lésées sur le "câblage nerveux nociceptif" que le cerveau reçoit des influx douloureux anormaux qui souvent se manifestent par d'énormes distorsions dans le signal nociceptif.
Ce message nociceptif "brouillé et distordu" peut prendre deux aspects:
-
être continu et alors des douleurs "qui font mal" sans autre caractère que celui de douleurs "douleurs" ou encore des douleurs cette fois-ci "accompagnées" d'un ou de plusieurs caractères autre que celui de faire mal sont alors ressenties; les qualificatifs de paresthésies ou de dysesthésies donnés à la composante accompagnatrice sont en fait des échelles de degré d'intensité, une paresthésie devenant dysesthésie lorsque son intensité devient dérangeante (Voir: UN LEXIQUE "DOULOUREUX")
ou
- survenir par intermittence sous forme de décharges ou secousses soudaines et intenses, des douleurs paroxystiques ou "en salves" seront alors ressenties.
Bien que la définition "puriste" s'attarde au réseau nociceptif, la douleur neurogène peut tout aussi bien provenir de dommages qui se sont produits "dans le câblage nerveux sensitif non-nociceptif" soit celui véhiculé par les fibres A bêta. Dans ces cas, c'est toujours à partir des régions lésées mais cette fois-ci sur le "câblage nerveux sensitif non-nociceptif" que sont créées les douleurs neurogènes acheminées vers les neurones centraux qui se chargent alors d'envoyer vers le cerveau des influx douloureux anormaux qui encorre se manifestent par d'énormes distorsions dans le signal nociceptif. (Voir: LA DOULEUR NOCICEPTIVE: LES SUBSTANCES INFLAMMATOIRES, LA SENSIBILISATION)
135 - La douleur neurogène: les constituants anatomiques
La douleur neurogène est donc attribuable à des lésions affectant les voies nerveuses nociceptives, i.e. les fibres conduisant la douleur, et ce, à partir de n'importe quel nocicepteur en périphérie et ce jusqu'au cortex sensitif. La douleur neurogène peut tout aussi bien provenir de dommages dans le réseau sensitif non-nociceptif tel qu'expliqué précédemment. (Voir: LA DOULEUR NEUROGENE (OU NEUROPATHIQUE))
Ces lésions peuvent toucher
- aussi bien les nocicepteurs
-
que tout élément du circuit nerveux nociceptif dont les composantes sont les structures suivantes:
- les nerfs périphériques,
- les plexus somatiques et viscéraux,
- les racines,
- les synapses,
- les faisceaux médullaires transportant les messages douloureux (faisceaux spinothalamiques et autres)
- le thalamus.
136 - La douleur neurogène: l'anatomie d'un nerf
Un nerf se compose d'un grand nombre de fibres nerveuses qui sont de calibres variables, ces fibres sont appelées neurones (Voir: LES FIBRES NERVEUSES OU NEURONES: LES DIFFERENTS TYPES). Certaines de ces fibres sont motrices, d'autres sont sensitives et parmi les fibres sensitives se trouvent les fibres nociceptives. Les nerfs périphériques sont habituellement mixtes i.e. moteurs et sensitifs, mais il y a des exceptions et cela touche particulièrement la branche postérieure de la racine postérieure qui elle n'est formée que de fibres sensitives dont une bonne part sont des fibres nociceptives (Voir: LE CIRCUIT NERVEUX SOMATIQUE: LA BRANCHE POSTERIEURE DE LA RACINE POSTERIEURE ET LES REFERENCES A DISTANCE).
L'anatomie d'un nerf peut se visualiser de la façon suivante:
- les fibres ne sont jamais laissées libres à elles-même, elles voyagent "en groupes" et ces groupes sont composés de fibres motrices et sensitives,
- le plus petit ensemble de fibres nerveuses regroupées ensemble dans un nerf forme un fascicule. Un fascicule est entouré d'une membrane, le périnèvre (perineurium). Ces fascicules peuvent être de diamètre fort variable,
- chaque neurone à l'intérieur d'un fascicule baigne, de façon isolée des autres, dans une substance conjonctive "lâche". Par ailleurs, toutes les fibres sauf les fibres C possèdent, en plus de cet isolant formé de substance conjonctive "lâche", leur propre isolant formé par de la myéline disposée en couche circulaire autour de la tige axonnale,
- un ensemble de fascicules regroupé les uns près des autres et entouré d'une membrane forment un nerf. La membrane entourant cet ensemble de fascicules s'appelle l'épinèvre (epineurium),
- chaque fascicule est enfin à son tour entouré de tissu adipeux, de tissu conjonctif lâche, de vaisseaux sanguins et de vaisseaux lymphatiques.
Le grand ensemble de fascicules formé de milliers et des milliers de fibres de divers types (A, B et C) dont certaines (A et B) se subdivisant en d'autres sous-types forme un nerf qui peut être comparé à un câble de réseau téléphonique contenant des millions de petits filaments électriques de couleurs variées mais dont chaque couleur aurait une fonction.
Chaque type et chaque sous-type de fibres transporte des informations différentes, certaines en provenance du cerveau, on les dit "efférentes", d'autres en direction de celui-ci, on les dit "afférentes". La douleur ou plutôt les divers types de douleur sont acheminés surtout par les fibres (A delta) et les fibres C.
137 - La communication et le transport des nutriments dans le neurone
Toutes les communications et tout le transport des nutriments à l'intérieur du neurone se font au moyen de tubules (microtubules ou neurotubules) disposés à l'intérieur des axones et des dendrites. Ces neurotubules servent donc au transport des protéines, des enzymes, des neurotransmetteurs et de nombreuses autres substances.
Le neurone utilise ces systèmes de transport tubulaires dans les deux sens, soit pour "aller porter" à partir du noyau vers la périphérie du nerf, soit pour "rapporter" de la périphérie vers le corps cellulaire le matériel et les informations impliqués dans le maintien de l'équilibre structural ou affectant l'homéostasie fonctionnelle du neurone. Les messages provenant de la périphérie portent tout autant sur le milieu chimique "intraneuronal" que sur les composantes chimiques baignant les axones.
En tout temps, le corps cellulaire de chaque neurone demeure donc "bien branché" avec les événements environnementaux, qu'ils soient extracellulaires ou intracellulaires. Ce branchement repose sur deux types de messages:
-
des messages chimiques intracellulaires ou "intraneuronaux"
mais aussi - les messages électriques conduits à la surface des membranes neuronales.
Cette double utilisation des neurotubules par les neurones permettra de comprendre en détails les nombreux "remaniements" rencontrés dans la "chimie et l'électronique" de la douleur, lorsque le tissu nerveux subit des lésions. Le projet actuel insistera surtout sur les événements associés au contexte "oncologique" et responsables de lésions sur le tissu nerveux surtout nociceptif. Il sera ainsi fait mention des anomalies rencontrées lorsque du tissu néoplasique se développe au pourtour du tissu nerveux ou lorsque des fibres nerveuses sont agressées et lésées par des traitements que ces derniers soient une chirurgie, de la chimiothérapie ou de la radiothérapie.
Le neurone est ainsi bien muni pour recevoir tout signalement d'agressions sur les structures nerveuses. Par ailleurs, le temps de réaction du neurone en face de toute agression est bref, en dedans d'une heure. Mais il y a un prix à payer, la paroi des neurotubules est constituée de protéines qui sont fragiles aux traumatismes mécaniques et à différentes substances chimiques "nocives".
Lorsqu'un axone est sectionné, la partie qui demeure rattachée au corps cellulaire tente de survivre alors que l'autre partie, la partie distale, complètement coupée de ses nutriments en provenance du corps cellulaire, dégénère et meurt. (Voir: LE PHENOMENE DE DESAFFERENTATION)
Cette tentative de survivre vise la récupération de son intégrité structurelle et fonctionnelle. On verra dans ce premier manuel que, bien que les neurones lésés puissent réussir tant bien que mal à retrouver une certaine intégrité structurelle, les circuits nociceptifs seront bien souvent très loin d'avoir retrouvé leur intégrité fonctionnelle "électrique" d'où la source des messages nociceptifs erratiques qui deviendront sur le plan clinique des douleurs neurogènes.
138 - La douleur neurogène: son origine clinique
Les agressions aux fibres nerveuses et les lésions qui en découlent peuvent résulter de conditions nombreuses et diverses. Dans le contexte des soins palliatifs "oncologiques", ces lésions peuvent résulter:
-
d'une masse tumorale présente dans l'environnement immédiat du tissu nerveux et qui, de par son évolution, peut progressivement
- comprimer les structures nerveuses (nerf, plexus, racine) tout d'abord,
- infiltrer ensuite ces mêmes structures nerveuses en raison de la croissance désordonnée des cellules néoplasiques de cette masse qui envahissent l'épinèvre et ensuite plus loin les différents périnèvre (Voir: LA DOULEUR NEUROGENE: L'ANATOMIE D'UN NERF),
-
entraîner par la suite le sectionnement d'un certain nombre de fibres nerveuses axonales, la partie proximale réussissant habituellement à survivre parfois au prix d'une grande instabilité électrique (la douleur neurogène) alors que la partie distale dégénère.
-
de certains traitements tels
- la radiothérapie qui peut entraîner des effets toxiques sur les fibres nerveuses soumises localement à la radiation,
- la chirurgie qui peut provoquer un sectionnement et donc des dommages aux fibres nerveuses et aux nocicepteurs,
- la chimiothérapie qui peut aussi exercer à sa façon des effets toxiques sur les fibres nerveuses. Ainsi, certaines substances employées en chimiothérapie sont bien connues pour leur neurotoxicité, telles ...
-
- Cisplatine - Vincristine - Vinblastine - Vinorelbine - Docetaxel - Paclitaxel - Procarbazine - Etoposide.
Le détail de cette toxicité dépasse largement le cadre de ces documents, il ne sera donc pas explicité plus avant.
En dehors du contexte immédiat des soins palliatifs "oncologiques", plusieurs autres conditions peuvent créer des lésions aux fibres nociceptives et ainsi entraîner des douleurs neurogènes:
- certaines infections, notamment le zona,
- certaines maladies métaboliques telles le diabète,
- certaines intoxications telle l'intoxication aux métaux lourds,
- certaines affections auto-immunes comme la sclérose en plaques comme le plomb
-
certaines affections auto-immunes comme la sclérose en plaques,
enfin, - certains traumatismes comme la compression soutenue d'un nerf, l'étirement violent d'un nerf ou d'un plexus soit par exemple l'avulsion du plexus brachial et certaines blessures par armes blanches ou par balles peuvent entraîner des douleurs neurogènes, via une action directe ou indirecte sur les fibres nociceptives.
Bien que des lésions au tissu nerveux soient souvent la cause de douleurs neurogènes, il faut reconnaître que le tissu nerveux lésé n'est pas toujours synonyme de douleur. L'évolution observée à la suite d'une amputation en est un bon exemple. Les fibres nécessairement sectionnées au moment de l'amputation sont parfois responsables des douleurs dites "fantômes" alors que l'amputation chez d'autres personnes ne laisse aucune séquelle douloureuse à long terme. Le corps a aussi ses raisons que la raison ne sait pas toujours comprendre !!!
139 - Douleur neurogène et masse tumorale: la séquence compression - infiltration - sectionnement
En ce qui a trait à la compression tumorale, il importe de signaler que la compression résulte d'abord de l'oedème présent au niveau de la masse tumorale et au pourtour immédiat de celle-ci avant que cette compression ne résulte vraiment de la masse.
Classiquement dans nos enseignements, la notion d'oedème péritumoral est présentée comme s'il s'agissait d'une exclusivité retrouvée au pourtour de masses tumorales cérébrales primaires ou métastatiques. Cependant, il faut lever cette "fausse exclusivité" puisque la présence de cet oedème ne se limite pas exclusivement au pourtour du tissu tumoral présent dans le cerveau. De l'oedème péri-tumoral, avec une intensité variable, se forme en fait au pourtour de tout tissu tumoral, où qu'il se trouve dans l'organisme.
C'est donc l'oedème péri-tumoral au début qui comprime les fibres nerveuses touchées. A cet effet de compression extrinsèque, s'ajoute subséquemment un oedème intraneuronal, signe ou témoin de la souffrance axonale.
Cette compréhension "élargie" d'un phénomène qui semble ne recevoir d'attention qu'au niveau du cerveau trouve une des ses applications dans le chapitre des co-analgésiques, particulièrement à la section portant sur les corticostéroïdes où ces substances seront présentées comme pouvant réduire les douleurs neurogènes dans les contextes d'agressions tumorales actives. Ce thème sera abordé dans le manuel III portant sur les co-analgésiques.
La masse tumorale, si elle a continué de croître, ne fera compression que beaucoup plus tard sur les structures nerveuses d'abord touchées par l'oedème péritumoral alors qu'elle finira par occuper le volume qui, quelques semaines ou quelques mois plus tôt, était occupé par l'oedème péri-tumoral. L'effet analgésique des corticostéroïdes sera alors perdu!
Durant l'évolution du cancer, il importe également de souligner que la croissance anarchique des cellules dans la masse tumorale pourra entrainer des manifestations variées:
- en certaines régions, se fera une compression directement par l'oedème,
- dans d'autre zones, c'est la masse tumorale elle-même qui comprimera directement,
- ailleurs, les cellules tumorales, qui se multiplient de façon "complètement folle", infiltreront les membranes (épinèvre) d'un ou de plusieurs nerfs, par la suite les membranes des fascicules (périnèvre) et pénétreront ainsi jusqu'aux axones,
- dans d'autres zones finalement, le processus d'infiltration aura déjà entraîné le sectionnement d'un certain nombre d'axones et si le processus a pu prendre de l'ampleur, c'est le sectionnement du nerf, de la branche d'un plexus ou d'une racine dans son entier qui en résultera alors.
C'est à partir du sectionnement d'un certain nombre d'axones dans un nerf, une branche de plexus ou une racine que la désafférentation prend place avec son fardeau de conséquences cliniques. Cette désafférentation peut être:
-
incomplète, lorsqu'un certain nombre d'axones seulement ont été sectionnés alors que le nerf, la branche du plexus ou la racine demeurent
ou - complète lorsque tous les axones composant le nerf, la branche du plexus ou la racine ont été sectionnés (Voir: LA DOULEUR NEUROGENE PAROXYSTIQUE OU "EN SALVES" OU DE DESAFFERENTATION et LE PHENOMENE DE DESAFFERENTATION).
Ces différents phénomènes peuvent se produire autant au niveau d'un nerf, d'un plexus que d'une racine.
Il faut conserver cette vision microscopique de l'envahissement tumoral pour bien comprendre pourquoi plusieurs types de douleurs peuvent se développer dans une même région du corps tout comme pourquoi une douleur peut être ressentie dans une région où la sensibilité tactile est disparue. Cette description "microscopique" de l'invasion tumorale touche l'ensemble des fibres composant un nerf puisque chaque fibre (A, B et C) transportent des informations spécifiques et fort différentes. Ainsi une douleur ressentie dans une région où la sensibilité tactile est disparue s'explique par le simple fait que les neurones nociceptifs ont gardé une activité électrique "erratique" bien sûr alors que la conduction pour la sensibilité tactile a été détruite.
140 - Les lésions nerveuses: les différentes anomalies pathophysiologiques à court terme
Tel qu'expliqué précédemment, la douleur neurogène est attribuable à différents types d'agressions subies par les fibres nociceptives des voies somatiques ou viscérales.
Ces agressions peuvent être de divers types:
- chimiques,
- biochimiques,
- mécaniques.
Diverses anomalies pathophysiologiques découlant des agressions causées par le tissu néoplasique ou par les traitements "antinéoplasiques" appliqués peuvent être observées sur l'étendue du réseau nociceptif, autant à court qu'à moyen et à long terme.
A court terme:
-
en réponse aux dommages de plus en plus sévères exercés sur les membranes axonales, la première réaction d'un neurone est de tenter de régénérer son intégrité structurelle et fonctionnelle. Lorsqu'un dommage est produit, la tentative de régénérescence "axonale" est très rapide. En l'espace d'une heure, le corps cellulaire fournit tous les nutriments pour qu'une membrane neuronale nouvelle vienne "fermer" complètement la brèche pratiquée sur par le processus "agresseur" sur la membrane neuronale originale. Ce rapide mécanisme de réparation vise ainsi à rétablir la continuité membranaire nécessaire à l'intégrité neuronale. Les événements agresseurs avaient déjà induit une assez forte instabilité dans les membranes neuronales des fibres nociceptives lésées. Le processus de réparation amène à son tour des zones d'instabilité électrique puisque les membranes "nouvelles" connaissent beaucoup de zones focales de dépolarisation apparaissant comme spontanément. Ces zones qui sont en fait des mélanges d'agression et de regénération dans des environnement restreints deviennent de plus en plus instables sur le plan électrique, ce qui finit par provoquer des trains d'influx nociceptifs "ectopiques". (Voir: LE PHENOMENE DE DEPOLARISATION "MEMBRANAIRE" ET LE SEUIL D'ACTIVATION)
-
en même temps et dans les heures qui suivent, apparaissent à la surface des membranes neuronales nouvelles et "toutes jeunes", des bourgeons de régénérescence qui sont en fait des excroissances qui s'étendent vers les régions distales dans le but que le neurone "lésé" puisse rétablir contact avec la portion de neurone distal dont il a été "séparé" en raison des brèches ou du sectionnement provoqués. Ce faisant, le neurone tente de rétablir la communication avec la structure qu'il avait comme fonction d'innerver. Ces bourgeons de régénérescence, qui sont en fait des repousses axonales, se permettent parfois de longs trajets à travers les nerfs dans le but de retrouver contact avec leur zone d'innervation d'origine.
-
-
On retrouve ainsi des tentatives de régénérescence ou de repousses axonales sous deux types:
-
de courts bourgeons de régénérescence
et - de longs bourgeons ou prolongements parfois même très longs.
-
Lorsque le sectionnement s'est produit "en périphérie" chez des fibres préalablement myélinisées (A delta, A bêta et A alpha), un certain nombre de ces neurones recherchent à nouveau l'abri des cellules de Schwann, productrices de myéline, afin d'acquérir l'isolement dont ils bénéficiaient auparavant. Lorsque le phénomène se produit "au niveau central", certains de ceux-ci recherchent l'abri de myéline produit par les oligodendrocytes, équivalent central des cellules de Schwann en périphérie.
Ces bourgeons, i.e. leur membrane pour être plus précis, présentent par ailleurs une sensibilité accrue à différents types de stimulation mécanique et chimique, il devient donc plus facile de faire naître des influx douloureux puisqu'ils sont plus facilement irrités à des intensité de stimulation qui normalement seraient sans effet et qu'ils sont irrités par plusieurs variétés de mécanismes.
141 - Les lésions nerveuses: les différentes anomalies pathophysiologiques à moyen et long terme
A moyen et à long terme, des anomalies un peu plus tardives dites d'adaptation ou de plasticité deviennent observables à différents niveaux.
-
Dans la région du corps cellulaire du neurone périphérique i.e. dans la région du ganglion rachidien
-
en réponse à l'hyperactivité métabolique découlant des différents processus menant aux réparations membranaires et aux tentatives de branchement des portions liées au corps cellulaire avec leur portion plus distale du même neurone, la membrane neuronale du corps cellulaire se modifie à son tour. Elle commence à développer des repousses membranaires à l'allure des bourgeons de régénérescence. Ceci se produit dans la région du renflement radiculaire (ganglion radiculaire ou rachidien) où se trouve le noyau du neurone. Les membranes nouvelles et "toutes jeunes" qui apparaissent à ce niveau présentent elles-aussi une forte instabilité électrique et une sensibilité accrue à différents types de stimulation mécanique et chimique. Il devient donc chaque fois plus risqué de voir naître des influx douloureux.
-
en réponse à l'hyperactivité métabolique découlant des différents processus menant aux réparations membranaires et aux tentatives de branchement des portions liées au corps cellulaire avec leur portion plus distale du même neurone, la membrane neuronale du corps cellulaire se modifie à son tour. Elle commence à développer des repousses membranaires à l'allure des bourgeons de régénérescence. Ceci se produit dans la région du renflement radiculaire (ganglion radiculaire ou rachidien) où se trouve le noyau du neurone. Les membranes nouvelles et "toutes jeunes" qui apparaissent à ce niveau présentent elles-aussi une forte instabilité électrique et une sensibilité accrue à différents types de stimulation mécanique et chimique. Il devient donc chaque fois plus risqué de voir naître des influx douloureux.
-
Dans la portion synaptique de la corne postérieure,
-
les terminaisons présynaptiques des neurones nociceptifs périphériques s'arborisent en de multiples nouvelles projections qui vont envahir de nouveaux territoires de la corne postérieure i.e. des nouvelles couches (laminae) et ainsi créer de "nouvelles connexions" synaptiques qui vont devenir en fait de "mauvaises connexions" puisque ces connexions se feront de façon inappropriée dans des couches et avec des cellules non désirées.
On assiste alors à l'émergence d'un élargissement des champs récepteurs (Voir: LE TERMINUS PERIPHERIQUE ET LE PREMIER RELAIS CENTRAL: LA CORNE POSTERIEURE ET SA CONSTITUTION EN COUCHES) tout aussi erratique que les nouvelles connexions peuvent l'être. Ainsi, des neurones centraux déjà impliqués dans les échanges nociceptifs (neurones spinothalamiques et autres) voient s'ajouter de nouvelles surfaces synaptiques à celles qu'ils possèdaient déjà et qui avaient été voulues par l'architecture physiologique normale. Mais il y a plus, des neurones centraux qui ne participaient pas aux échanges nocicepitfs avec les fibres lésées reçoivnet à leur tour un lot de "nouvelles connexions" synaptiques "indésirables". Ces nouvelles connexions indésirables se font dans les étages médullaires segmentaires déjà impliqués mais ils s'avancent aussi dans de nouveaux étages médullaires, augmentant de ce fait l'étalement multi-étagé déjà présent de par la physiologie normale. A partir de ces événements, des étages relativement plus éloignés reçoivent des influx nociceptifs dépassant largement leur champ dermatomique usuel. Les surfaces douloureuses s'élargissent en même temps.
-
les terminaisons présynaptiques des neurones nociceptifs périphériques s'arborisent en de multiples nouvelles projections qui vont envahir de nouveaux territoires de la corne postérieure i.e. des nouvelles couches (laminae) et ainsi créer de "nouvelles connexions" synaptiques qui vont devenir en fait de "mauvaises connexions" puisque ces connexions se feront de façon inappropriée dans des couches et avec des cellules non désirées.
-
-
Par ailleurs, les agressions sur le circuit nerveux ne se limitant pas aux fibres C et A delta, les fibres A bêta incluses dans les zones lésées connaissent le même sort. Ainsi, certaines projections provenant d'influx sensitifs non-nociceptifs et qui participaient à la modulation des échanges nociceptifs soit directement sur les cellules centrales, soit indirectement par le biais des interneurones s'arborisent dans leur portion présynaptique. Ce faisant, elles prennent souvent en même temps une tonalité "nociceptive". (Voir: LA DOULEUR NOCICEPTIVE: LES SUBSTANCES INFLAMMATOIRES, LA SENSIBILISATION / EPARPILLEMENT MULTI-ETAGE, MULTI-CONVERGENCE, DOULEUR IRRADIEE ET DOULEUR REFEREE / LE SYSTEME DE TRANSPORT DES INFLUX NOCICEPTIFS PERIPHERIQUES: L'EPARPILLEMENT MULTI-ETAGE / L'EPARPILLEMENT MULTI-ETAGE: LA DIFFERENCE ENTRE LES AFFERENCES SOMATIQUES ET VISCERALES)
L'élargissement des champs récepteurs et l'arrivée de nouvelles stimulations synaptiques "inappropriées" autant nociceptives que non-nociceptives produisent un débalancement dans l'équilibre habituel des différents "inputs" sensitifs arrivant au niveau de la moelle par les racines postérieures (Voir: LA CORNE POSTERIEURE: UNE "COUR DE TRIAGE" COMPLEXE).
en même temps, les influx qui arrivaient en provenance des fibres non-nociceptives et qui s'interconnectaient avec des interneurones pour apporter la contribution segmentaire des influx "inhibiteurs" au "portillon" segmentaire disparaissent en bonne partie puisque les fibres les transportant ont aussi connu des agressions. Il se fait donc beaucoup moins d'inhibition et parfois il ne se fait plus d'inhibition par le réseau des interneurones "enképhaline, dynorphine et GABA" impliqués dans le portillon segmentaire. Il en résulte donc un effet net d'accroissement du transfert des influx nociceptifs qui ne subissent plus l'effet modulateur du "portillon". Pire encore, certaines fibres A bêta ont même pris une tonalité "nociceptive", on parle alors de "conversion phénotypique". (Voir: LA DOULEUR NOCICEPTIVE: LES SUBSTANCES INFLAMMATOIRES, LA SENSIBILISATION)
-
Par ailleurs, les agressions sur le circuit nerveux ne se limitant pas aux fibres C et A delta, les fibres A bêta incluses dans les zones lésées connaissent le même sort. Ainsi, certaines projections provenant d'influx sensitifs non-nociceptifs et qui participaient à la modulation des échanges nociceptifs soit directement sur les cellules centrales, soit indirectement par le biais des interneurones s'arborisent dans leur portion présynaptique. Ce faisant, elles prennent souvent en même temps une tonalité "nociceptive". (Voir: LA DOULEUR NOCICEPTIVE: LES SUBSTANCES INFLAMMATOIRES, LA SENSIBILISATION / EPARPILLEMENT MULTI-ETAGE, MULTI-CONVERGENCE, DOULEUR IRRADIEE ET DOULEUR REFEREE / LE SYSTEME DE TRANSPORT DES INFLUX NOCICEPTIFS PERIPHERIQUES: L'EPARPILLEMENT MULTI-ETAGE / L'EPARPILLEMENT MULTI-ETAGE: LA DIFFERENCE ENTRE LES AFFERENCES SOMATIQUES ET VISCERALES)
-
en même temps, les influx qui arrivaient en provenance des fibres non-nociceptives et qui s'interconnectaient avec des interneurones pour apporter la contribution segmentaire des influx "inhibiteurs" au "portillon" segmentaire disparaissent en bonne partie puisque les fibres les transportant ont aussi connu des agressions. Il se fait donc beaucoup moins d'inhibition et parfois il ne se fait plus d'inhibition par le réseau des interneurones "enképhaline, dynorphine et GABA" impliqués dans le portillon segmentaire. Il en résulte donc un effet net d'accroissement du transfert des influx nociceptifs qui ne subissent plus l'effet modulateur du "portillon". Pire encore, certaines fibres A bêta ont même pris une tonalité "nociceptive", on parle alors de "conversion phénotypique". (Voir: LA DOULEUR NOCICEPTIVE: LES SUBSTANCES INFLAMMATOIRES, LA SENSIBILISATION)
-
On voit alors apparaître
-
une allodynie, i.e. des influx douloureux déclenchés par des stimuli qui ne sont habituellement pas nociceptifs, à titre d'exemple, effleurer de la main une surface cutanée,
- une hyperesthésie, i.e. des influx douloureux ressentis comme disproportionnés par rapport à la faible intensité des stimuli nociceptifs de déclenchement. A titre d'exemple, une piqûre superficielle légère sur une surface cutanée déclenchant de sévère douleur sur une large surface.
-
une allodynie, i.e. des influx douloureux déclenchés par des stimuli qui ne sont habituellement pas nociceptifs, à titre d'exemple, effleurer de la main une surface cutanée,
-
certaines terminaisons synaptiques des axones périphériques lésés cessent de libérer leur neurotransmetteur normal
- (substance P,
- calcitonine gene related peptide (CGRP),
- somatostatine,
- polypeptide intestinal vaso-actif (vasoactive intestinal peptide (VIP))
-
parce que l'agression est telle que le métabolisme au niveau du corps cellulaire est totalement perturbé. Après quelques jours, des neurotransmetteurs normaux mais en concentration nettement exagérée ou des neurotransmetteurs inhabituels apparaissent au niveau des terminaisons pré-synaptiques, notamment
- glutamate
- neuropeptide Y
- galanine
- vasoactive intestinal peptide (VIP).
Les neurones nociceptifs centraux connaissent alors une activité métabolique intensément productive en raison de l'hyperstimulation en provenance de la périphérie avec comme conséquence l'accentuation du nombre d'influx nociceptifs arrivant aux étages supérieures (tronc cérébral, circuits sous-corticaux et corticaux).
-
- le glutamate est alors appelé à jouer un rôle prépondérant dans l'amplification des douleurs découlant de ces différentes adaptations. Certains récepteurs "biochimiques" présents au niveau des membranes post-synaptiques des dendrites centraux et qui semblaient "dormants" deviennent en pleine activité, c'est le cas des récepteurs N-méthyl-D-aspartate (NMDA). Cet "éveil" aura des conséquences délétères majeures comme il a déjà été expliqué plus avant (Voir: LES RECEPTEURS NMDA ET ... LES RECEPTEURS NON-NMDA: LEURS ROLES EN SITUATION D'HYPERACTIVITE PERIPHERIQUE).
L'hyperstimulation en provenance de la périphérie devient tellement intense qu'une certaine activité "spontanée" apparaît au niveau des neurones centraux nociceptifs. Cette hyperstimulation fait partie intégrante et conduit en même temps au phénomène de "wind-up" par lequel les neurones nociceptifs centraux deviennent de plus "irritables" au point de présenter une activité presque "spontanée" lorsqu'ils sont soumis à des stimulations répétées intenses. Après quelques heures à quelques jours de stimulations incessantes, en provenance des zones neuronales lésées, on assiste à une rapide élévation de l'intensité des douleurs puisque les stimuli douloureux ne sont même plus nécessaires au déclenchement de douleurs vives, les neurones centraux étant devenus en quelque sorte de quasi "pacemakers nociceptifs". En laboratoire, le phénomène de "wind-up" se produit à la suite de stimulations douloureuses répétées dans un même site dépassant une fréquence de 2 à 3 stimuli par secondes pendant quelques heures.
-
- l'activité d'interneurones inhibiteurs utilisant la dynorphine augmente à son tour de façon très considérable.
- bon nombre de terminaisons synaptiques ainsi impliquées connaissent une réduction de leur dimension en raison d'un "épuisement fonctionnel" qui va mener à plus long terme à une mort cellulaire d'un certain nombre de celles-ci.
- Dans la portion segmentaire du réseau sympathique, correspondant aux étages où des neurones subissent l'agression tumorale, l'activité sympathique s'accentue considérablement avec les conséquences dont il a été fait mention précédemment. (Voir: LE SYSTEME "SYMPATHIQUE" ... QU'IL NE FALLAIT PAS OUBLIER! / LES DOULEURS COMPLIQUEES D'UNE PARTICIPATION "SOUTENUE" DU SYSTEME NERVEUX AUTONOME SYMPATHIQUE / HYPEREXCITATION ET HYPEREXCITABILITE DES RECEPTEURS NMDA: LES PROVENANCES POSSIBLES DANS UN CONTEXTE DE SOINS PALLIATIFS ONCOLOGIQUES / HYPEREXCITATION ET HYPEREXCITABILITE DES RECEPTEURS NMDA: LES PROVENANCES POSSIBLES DANS UN CONTEXTE DE SOINS PALLIATIFS ONCOLOGIQUES)
L'augmentation des influx nociceptifs ectopiques en provenance des fibres nociceptives périphériques entraînent donc un état d'hyperexcitabilité marquée dans les neurones centraux de la corne postérieure, mais il y a plus. Les fibres C provoquent une hyperexcitabilité plus profonde que les fibres A delta; par ailleurs, les influx ectopiques des fibres C en provenance des structures musculo-squelettiques entraînent une hyperexcitabilité plus grande et plus prolongée que ceux provenant des structures cutanées. Il n'est peut-être plus nécessaire de s'étonner que les douleurs s'accompagnant d'une hyperactivité sympathique proviennent le plus souvent de lésions du système musculo-squelettique.
La simple présence de cellules tumorales dans le voisinage du tissu nerveux est finalement très loin d'être banale. Cette présence amène plutôt une kyrielle de conséquences toutes plus importantes les unes que les autres. Le simple inconfort évolue souvent rapidement vers des douleurs neurogènes fort dérangeantes qui posent défi à la gestion analgésique.
142 - Les lésions nerveuses: leur processus de réparation
La présence d'une agression "neuronale" causée par un prolifération néoplasique ou par un des multiples traitements antinéoplasiques entraîne à son tour une autre conséquence. En même temps que le processus de régénérescence et de tentative de réparation visant à reprendre contact avec la zone d'innervation d'origine se déroule, il se produit une importante réaction inflammatoire.
Ce processus inflammatoire de réparation amène assez rapidement la production de tissu fibreux qui se dépose, en amas plus ou moins importants, à l'intérieur et au pourtour des nerfs touchés, selon l'intensité de la réaction.
Lorsque le processus fibreux est relativement intense, les repousses axonales se trouvent freinées et s'enchevêtrent dans un amas cicatriciel. Il arrive que cet enchevêtrement prenne des proportions macroscopiques au point où un nodule peut devenir palpable, on réfère alors à cette structure comme étant un névrome.
Ce processus dynamique de réparation dans les fibres nociceptives lésées aura des conséquences majeures, comme nous le verrons bientôt.
On pourrait imaginer qu'il existe un lien entre l'intensité de l'agression, ses conséquences sur le processus de réparation et l'apparition de douleur neurogène. Ainsi, plus l'agression serait sévère, plus les conséquences seraient variées, diverses et intenses et plus la probabilité d'apparition de douleur neurogène de divers types serait élevée. C'est souvent le cas mais il arrive aussi parfois que des conséquences tout à fait démesurées apparaissent en terme de processus d'adaptations, conséquences aux répercussions tant physio-pathologiques que cliniques provoquant de sévères douleurs qui se chronicisent pour des lésions d'apparence banales. Comme message d'ordre général il faudrait peut-être insister sur le fait qu'aucune douleur ne devrait être négligée, ce qui devrait avoir comme effet de réduire le nombre de douleurs qui se chronicise. Pour ce faire, il faudrait que chaque type de douleur soit d'abord reconnu comme tel, chaque type posant en même temps un défi thérapeutique particulier, comme nous le verrons plus en détail dans les manuels III, IV et V de cette série.
143 - La douleur neurogène: quatre groupes pathophysiologiques / cliniques
La classification simplifiée dite "hybride" des douleurs physiques, proposée antérieurement dans ce manuel repose sur des bases anatomo-patho-physiologiques et cliniques. Chaque portion de cette classification peut être reliée d'une façon logique à certains processus pathophysiologiques discutés jusqu'à maintenant.
Cependant, il ne faut jamais interpréter chaque sous-type de douleur comme étant totalement isolé des autres événements pathophysiologiques prenant place en même temps. Bien au contraire, chaque type de douleur neurogène partage probablement plusieurs des mécanismes pathophysiLa classification simplifiée dite "hybride" des douleurs physiques, proposée antérieurement dans ce manuel, repose sur des bases anatomo-patho-physiologiques et cliniques. Chaque portion de cette classification peut être reliée d'une façon logique à certains processus pathophysiologiques discutés jusqu'à maintenant.
Les explications qui suivent représentent donc chaque fois une simplification exagérée d'un processus complexe. Elles sont cependant proposées afin d'aider à la compréhension des mécanismes complexes engendrant des douleurs.
La douleur neurogène se divise en trois types cliniques courants:
- la douleur simple, par exemple, la douleur attribuable à une compression radiculaire par hernie discale
- la douleur "accompagnée" de paresthésies ou de dysesthésies, par exemple, les douleurs post-herpétiques ou post-zona
- la douleur paroxystique ou "en salves" également appelées de façon erronée "douleur de désafférentation", par exemple, le tic douloureux ou névralgie du trijumeau.
Il existe un quatrième type, plus rare,
-
la douleur complexe autrefois appelée dystrophie sympathique réflexe / causalgie et maintenant définie comme syndrome douloureux régional complexe (Complex Regional Pain Syndrome)
-
avec participation et rehaussement du système nerveux autonome sympathique, c'est la douleur avec participation sympathique / "Sympathetically Maintained Pain" avec comme exemple type la douleur accompagnant l'atrophie de Sudeck
ou - sans participation du système nerveux autonome sympathique, c'est la douleur sans participation sympathique / "Sympathetically Independant Pain".
-
avec participation et rehaussement du système nerveux autonome sympathique, c'est la douleur avec participation sympathique / "Sympathetically Maintained Pain" avec comme exemple type la douleur accompagnant l'atrophie de Sudeck
144 - La douleur neurogène: manifestations cliniques "classiques"
La douleur neurogène accompagnée (paresthésie / dysesthésie) est habituellement une douleur intense, sévère. Elle est généralement constante mais peut varier en intensité pendant la journée. Il n'y a habituellement pas de période de répit complet de douleur dans la journée, l'intermittence est plutôt rare. Un fond de douleur est toujours présent, chaque minute, chaque heure de chaque jour.
Cette douleur peut être perçue comme une sensation normale ou anormale. Elle est souvent décrite dans les textes comme "à fleur de peau" mais cette douleur peut tout aussi bien être ressentie en profondeur, l'impression rapportée alors étant celle de douleurs ressenties profondément dans les muscles ou dans les os.
Lorsque les sensations normales ou anormales sont dans un créneau d'intensité acceptable, on les dit "paresthésiques"; lorsqu'elles deviennent tellement intenses qu'elles en sont désagréables, on les dit "dysesthésiques". (Voir: UN LEXIQUE "DOULOUREUX")
La douleur neurogène accompagnée
- correspond classiquement à une sensation de brûlure. La sensation de brûlure peut aussi être perçue selon différents modes: ainsi, une impression d'eau bouillante qui s'écoulerait sur une région donnée, ainsi, une impression de brûlure cuisante comme celle d'avoir la main dans le feu ou d'être "marqué au fer rouge".
La douleur neurogène accompagnée
- peut également être perçue comme un prurit très intense, un picotement, un engourdissement intense sans répit. De nombreuses autres manifestations sensorielles sont souvent rapportées telles des élancements, la pointe d'un couteau qui tournerait dans une plaie vive, une sensation de crampe prolongée, des déchirements, des tiraillements, un écrasement, une torsion, un pincement, de la pression, quelque chose qui serre ou quelque chose qui pousse. Cette nomenclature élaborée est celle qu'il m'a été donné le plus souvent de rencontrer au fil des années. Le questionnaire d'évaluation des douleurs de Melzack fournit une liste beaucoup plus exhaustive de termes pouvant être rapporté pour décrire des douleurs.
Ces multiples caractères constituent une des principales différences avec la douleur neurogène simple qui elle, est perçue, comme une douleur purement "douleur".
Il est probablement arrivé à chacun de nous, au moins une fois dans sa vie, de heurter son coude pour soudainement ressentir un intense engourdissement voire une brûlure au petit doigt. Cet exemple peut servir à illustrer ce qu'est la douleur accompagnée (paresthésie / dysesthésie). On se devrait cependant d'en souligner deux différences majeures:
-
d'abord d'en amplifier considérablement l'intensité par rapport à ce qui est ressenti comme intensité au moment du "choc" sur le coude,
ensuite - de faire durer cette sensation déplaisante non pas quelques minutes tout au plus mais de la faire durer en permanence, 24 heures sur 24, jour après jour, semaine après semaine.
Voilà ce qu'est une douleur accompagnée (paresthésie / dysesthésie). Rien de moins.
145 - La douleur neurogène simple
La douleur neurogène simple peut être due à:
-
la compression du tissu nerveux par une masse tumorale. Cette compression, s'exprimant d'abord par un phénomène d'irritation neuronale causant une certaine instabilité électrique, n'est cependant pas suffisante pour conduire à la destruction axonale.
- des changements morphologiques variables au niveau des fibres nociceptives. Ces changements ne sont cependant pas reliés à la compression mais ils sont plutôt attribuables à d'autres facteurs diversifiés (diabète, chimiothérapie, chirurgie, radiothérapie, post-infection, etc.).
La compression ou les changements morphologiques exercés par ces agressions sont suffisants, cependant, pour générer une série d'influx nociceptifs qui respectent l'apparence normale des trains d'influx nociceptifs "normaux" dans les fibres touchées. Si on plaçait des électrodes quelque part sur les fibres lésées, autant dans leur portion périphérique que centrale, en autant que ces électrodes soient situées en aval des zones d'agressions, on constaterait que l'architecture des influx nociceptifs est d'apparence normale.
146 - La douleur neurogène simple: manifestations cliniques
Il est important de souligner que la sensation ressentie dans le cas de douleur neurogène simple en est une de
- douleur purement "DOULEUR"
sans aucun autre caractère ou particularité accompagnant cette douleur. Il n'y a donc pas de sensation de brûlure, prurit, engourdissement, picotement qui accompagnent certains sous-types de douleur neurogène.
C'est l'ensemble douleur-"DOULEUR" qui constitue donc le descriptif-clé dans le cas présent. Cette douleur-"DOULEUR" est comparable en tout point à la douleur nociceptive somatique mais elle n'origine pas de la stimulation de nocicepteurs. Il ne se trouve pas de zones périphériques porteuses d'activités inflammatoires dans la périphérie de nocicepteurs d'où pourraient provenir ces douleurs.
L'intensité de la douleur neurogène simple peut varier de légère à sévère.
Cette douleur peut être intermittente ou constante. Qu'elle soit intermittente ou constante, elle présente le plus souvent des fluctuations de l'intensité à différents moments de la journée.
147 - La douleur neurogène simple: représentation schématique
Cette illustration suggère une représentation schématique du caractère de constance ou d'intermittence de même que des fluctuations dans l'intensité à différents moments de la journée que la douleur neurogène simple peut présenter.
148 - La douleur neurogène accompagnée (paresthésie / dysesthésie)
La douleur neurogène accompagnée (paresthésie / dysesthésie) peut être due à:
-
une compression nerveuse relativement importante et suffisante pour causer une instabilité électrique se manifestant par une symptomatologie différente de la douleur "douleur",
-
une infiltration du tissu nerveux par des cellules néoplasiques alors responsables de changements morphologiques et électriques,
-
des changements morphologiques variables au niveau des fibres nociceptives, changements cependant non reliés à la compression ou à l'infiltration mais attribuables à divers autres facteurs (diabète, chimiothérapie, chirurgie, radiothérapie, séquelles post-infection).
Bien que ces conditions soient susceptibles d'entraîner des lésions au niveau des fibres nerveuses, elles n'occasionnent pas de destruction massive des axones. Les lésions sont suffisantes, cependant, pour entrainer une telle instabilité électrique au niveau des membranes lésées que des influx nociceptifs la plupart du temps en continue (des trains d'influx continus) sont alors observés. Ces influx dépassent par ailleurs largement par leur apparence aux lectures électrophysiologiques le tableau que l'on observe lors d'une conduction normale.
149 - La douleur neurogène accompagnée (paresthésie / dysesthésie): manifestations cliniques
La douleur neurogène accompagnée (paresthésie / dysesthésie) est habituellement une douleur intense, sévère. Elle est généralement constante mais peut varier en intensité pendant la journée. Il n'y a habituellement pas de période de répit complet de douleur dans la journée, l'intermittence est plutôt rare. Un fond de douleur est toujours présent, chaque minute, chaque heure de chaque jour.
Cette douleur peut être perçue comme une sensation normale ou anormale. Elle est souvent décrite dans les textes comme "à fleur de peau" mais cette douleur peut tout aussi bien être ressentie en profondeur, l'impression rapportée alors étant celle de douleurs ressenties profondément dans les muscles ou dans les os.
Lorsque les sensations normales ou anormales sont dans un créneau d'intensité acceptable, on les dit "paresthésiques"; lorsqu'elles deviennent tellement intenses qu'elles en sont désagréables, on les dit "dysesthésiques". (Voir: UN LEXIQUE "DOULOUREUX")
La douleur neurogène accompagnée
- correspond classiquement à une sensation de brûlure. La sensation de brûlure peut aussi être perçue selon différents modes: ainsi, une impression d'eau bouillante qui s'écoulerait sur une région donnée, ainsi, une impression de brûlure cuisante comme celle d'avoir la main dans le feu ou d'être "marqué au fer rouge".
La douleur neurogène accompagnée
- peut également être perçue comme un prurit très intense, un picotement, un engourdissement intense sans répit. De nombreuses autres manifestations sensorielles sont souvent rapportées telles des élancements, la pointe d'un couteau qui tournerait dans une plaie vive, une sensation de crampe prolongée, des déchirements, des tiraillements, un écrasement, une torsion, un pincement, de la pression, quelque chose qui serre ou quelque chose qui pousse. Cette nomenclature élaborée est celle qu'il m'a été donné le plus souvent de rencontrer au fil des années. Le questionnaire d'évaluation des douleurs de Melzack fournit une liste beaucoup plus exhaustive de termes pouvant être rapporté pour décrire des douleurs.
Ces multiples caractères constituent une des principales différences avec la douleur neurogène simple qui elle, est perçue, comme une douleur purement "douleur".
Il est probablement arrivé à chacun de nous, au moins une fois dans sa vie, de heurter son coude pour soudainement ressentir un intense engourdissement voire une brûlure au petit doigt. Cet exemple peut servir à illustrer ce qu'est la douleur accompagnée (paresthésie / dysesthésie). On se devrait cependant d'en souligner deux différences majeures:
-
d'abord d'en amplifier considérablement l'intensité par rapport à ce qui est ressenti comme intensité au moment du "choc" sur le coude,
ensuite - de faire durer cette sensation déplaisante non pas quelques minutes tout au plus mais de la faire durer en permanence, 24 heures sur 24, jour après jour, semaine après semaine.
Voilà ce qu'est une douleur accompagnée (paresthésie / dysesthésie). Rien de moins.
150 - La douleur neurogène accompagnée (paresthésie / dysesthésie): représentation schématique
Cette illustration suggère une représentation schématique du caractère généralement constant de la douleur neurogène accompagnée (paresthésie / dysesthésie) bien que des fluctuations dans l'intensité à différents moments de la journée puissent se présenter. Il n'y a habituellement pas de période de répit complet de ce type de douleur dans la journée. Cela étant dit, cette douleur peut aussi se présenter à l'occasion par intermittence bien que ce mode de présentation soit plutôt rare dans les faits.
Notes personnelles dans une perspective de soins palliatifs "oncologiques" Par : Brizard, André, MD
151 - La douleur neurogène paroxystique ou "en salves"
La douleur neurogène paroxystique ou "en salves" souvent comprise dans un sens large et erroné comme étant l'équivalent d'une douleur "par désafférentation" peut être due à:
-
une compression nerveuse sévère, responsable d'une instabilité électrique se manifestant par des épisodes soudains et intenses de douleurs,
-
une infiltration du tissu nerveux par des cellules néoplasiques dont la progression et la sévérité auront causé d'intenses dommages aux structures neuronales à commencer par les membranes et les microtubules responsables du transport des nutriments intracellulaires. Certains neurones pourront ainsi avoir subi un sectionnement (ils auront été déafférentés) alors que de nombreux autres neurones, malgré l'intensité de l'agression, auront réussi "à survivre" mais au prix de transformations profondes dans leur structure et dans leur stabilité électrique,
- des changements morphologiques variables au niveau des fibres nociceptives, changements cependant non reliés à la compression ou à l'infiltration tumorale mais attribuables à divers autres facteurs (diabète, chimiothérapie, chirurgie, radiothérapie, séquelles post-infection, séquelles post-traumatisme etc.).
152 - Le phénomène de désafférentation
A la différence du contexte des douleurs accompagnées, ces conditions sont, dans l'ensemble, susceptibles d'occasionner une destruction plus massive des neurones nociceptifs (... et aussi des autres neurones tant sensoriels que moteurs). Toujours à la différence des douleurs accompagnées, ces lésions n'entrainent pas d'instabilité électrique en continue au niveau des membranes lésées, l'instabilité électrique se manifeste plutôt en paroxysmes ou en salves.
Le phénomène de désafférentation se produit lorsque l'agression neuronale a été suffisante pour provoquer l'équivalent d'un sectionnement d'un neurone afférent (nociceptif ou de tout autre neurone sensitif) créant de ce fait une dénervation neuronale c'est-à-dire une perte de communication entre la partie distale i.e. celle rattachée aux différents nocicepteurs et la partie proximale qui elle est rattachée à la portion synaptique et qui permet d'assurer la communication avec les neurones nociceptifs centraux. Cette dernière portion (la partie proximale) contient le corps cellulaire ainsi que le noyau logés au niveau du renflement radiculaire appelé "ganglion radiculaire". La désafférentation est un état de fait, elle est la résultante de processus agresseurs sur les neurones.
La désafférentation peut être due à:
- une compression nerveuse sévère qui a entraîné de la nécrose neuronale
- une infiltration du tissu nerveux par des cellules néoplasiques dont la progression aura causé le sectionnement de nombreux axones,
- des changements morphologiques variables attribuables à divers facteurs (diabète, chimiothérapie, chirurgie, radiothérapie, post-infection, traumatisme etc.) dont l'importance aura été telle qu'ils auront entraîné à leur tour de la nécrose neuronale et un sectionnement.
Dans la compréhension conceptuelle du phénomène de désafférentation, il importe de différencier désafférentation au niveau neuronal et désafférentation au niveau d'un nerf, d'un plexus ou d'une racine.
Ainsi, lorsque considérée à l'échelle du neurone,
- la désafférentation ne peut être qu'entière, le neurone étant sectionné ou non i.e. ayant totalement perdu la communication avec la portion distale.
Cependant, considérée à l'échelle d'un nerf, d'un plexus ou d'une racine,
- le phénomène de désafférentation peut alors être partiel ou complet, selon le pourcentage d'axones sectionnées dans la structure concernée (Voir: DOULEUR NEUROGENE ET MASSE TUMORALE: LA SEQUENCE COMPRESSION - INFILTRATION - SECTIONNEMENT). La destruction partielle d'un nerf, plexus ou d'une racine mène à de la désafférentation "partielle" alors que la destruction complète, i.e. celle résultant du sectionnement de tous les neurones "nociceptifs" composant un nerf, un plexus ou une racine réfère à une désafférentation "complète"; dans ce cas, les autres axones sont habituellement sectionnés eux aussi. Ainsi, une amputation d'un membre mène à un sectionnement complet c'est-à-dire à une désafférentation complète pour les neurones sensitifs alors que l'envahissement d'un plexus par une masse tumorale mène d'abord à une désafférentation partielle qui peut ultimement évoluer vers une désafférentation complète.
Comme expliqué précédemment, ces agressions focalisées ou disséminées entraînent une importante réaction inflammatoire. Cette importante réaction inflammatoire accompagnera le processus de réparation neuronale dans toutes ses étapes. Il y aura donc toujours production et accumulation progressive de tissu fibreux cicatriciel dans le pourtour des zones de réparation et de regénération. Les zones ainsi touchées sont plus particulièrement les zones où se sont déroulées:
-
des fermetures des brèches
et
- des tentatives de régénération membranaire axonale ou dendritique. Dans ces régions apparaissent des repousses appelées projections ou ramifications ou excroissances ou repousses ou bourgeons de regénération dont le nombre variera selon les circonstances.
Le processus de régénération axonale menant à la production de projections multifocales vise au moins deux grands objectifs:
-
redonner une intégrité neuronale à chaque neurone lésé en réparant et en fermant les brèches,
- rétablir la connexion, grâce aux projections ou aux repousses, avec les portions les plus distales des axones lésés afin de reprendre la communication avec la zone d'innervation périphérique "perdue", aussi distante soit elle. Cette zone périphérique "perdue" consiste en fait des champs récepteurs appartenant aux nocicepteurs qui ont été désafférentés. Ces processus de regénération donnent parfois, dans leur cheminement à travers le réseau nerveux lésé (nerf, plexus ou racine), de très longs prolongements "relativement ramifiés" et "passablement erratiques".
Sur le plan physiopathologique, les portions "réparées" des neurones (brèches réparées ou repousses nouvelles) sont des portions qui connaissent la plupart du temps beaucoup d'instabilité sur le plan électrique. Des influx nociceptifs de types autant continus que paroxystiques sont alors susceptibles de prendre naissance dans ces régions, influx qui deviendront des douleurs neurogènes dans la définition la plus pure de ce type de douleur. Par ailleurs, ces portions "réparées" finissent par baigner dans des amas de fibrose à travers lesquels la médication ne pénètre que très difficilement, les zones de fibrose étant en elles-même très peu perméables à tout type de substance. Certaines de ces régions conserveront cette "hyperexcitabilité électrique" en permanence lorsque tous les processus inflammatoires auront été terminés et qu'il ne restera que des "amas neuronaux désorganisés" intégrés dans des "paquets de fibrose" cicatricielle rigide. La gestion pharmacologique des douleurs neurogènes originant de ces conditions sera donc bien souvent malheureusement limitée.
C'est dans de tels contextes qu'on associe souvent "douleurs paroxystiques", "phénomène de désafférentation" et même "douleurs de désafférentation". Cependant, dans les faits, douleurs paroxystiques et phénomène de désafférentation ne sont pas synonymes, la désafférentation étant par définition un phénomène anatomique alors que les douleurs paroxystiques sont des phénomènes électrophysiologiques qui ont plus souvent tendance à se produire en présence de désafférentation.
153 - Lésions nerveuses: processus de régénération neuronale et concept de plasticité neuronale
En rapport avec des situations d'agression sur le réseau nociceptif, il a été dit jusqu'à maintenant que ces agressions entraînaient un processus de réparation et de régénération de la membrane neuronale (brèches, repousses parfois très longues) et que ces zones de réparation possédaient une excitabilité électrique accrue qui est susceptible de mener à la création d'influx nociceptifs "ectopiques". En fait, le processus de réparation et de régénération neuronale avec l'instabilité qui s'ensuit contribue à un des volets des transformations profondes que vivent les neurones face à des agressions, transformations qui sont regroupées sous le concept de plasticité neuronale.
Ces processus s'accompagnent de deux conséquences redoutables qui font toutes les deux parties intégrantes du phénomène de plasticité neuronale:
-
l'activation des NMDA
et - la participation du système nerveux autonome sympathique.
L'hyperexcitabilité électrique dans les fibres périphériques lésées a pour conséquence d'augmenter la production et la libération de neurotransmetteurs nociceptifs, ce qui est susceptible de mener à l'activation des récepteurs NMDA qui, à leur tour, amplifieront le message nociceptif (wind-up) directement au niveau de la membrane neuronale du neurone central (c'est la membrane post-synaptique de la zone d'échanges nociceptifs au niveau de la corne postérieure). A regret parfois, cette amplification s'installera en permanence pour contribuer aux douleurs chroniques (Voir: LES RECEPTEURS NMDA ET ... LES RECEPTEURS NON-NMDA: LEURS ROLES EN SITUATION NORMALE et LES RECEPTEURS NMDA ET ... LES RECEPTEURS NON-NMDA: LEURS ROLES EN SITUATION D'HYPERACTIVITE PERIPHERIQUE).
Par ailleurs, cette même hyperexcitabilité électrique dans les fibres périphériques lésées amène le système nerveux autonome sympathique (SNAS) à participer lui aussi à sa façon à amplifier le message nociceptif en agissant directement sur les nocicepteurs en périphérie. (Voir: LE SYSTEME "SYMPATHIQUE" ... QU'IL NE FALLAIT PAS OUBLIER! / LA MULTI-CONVERGENCE ET SES REPERCUSSIONS: LE DECLENCHEMENT D'UNE REPONSE SYMPATHIQUE REFLEXE HYPERACTIVE / LES DOULEURS COMPLIQUEES D'UNE PARTICIPATION "SOUTENUE" DU SYSTEME NERVEUX AUTONOME SYMPATHIQUE / LE SYSTEME "SYMPATHIQUE" ... QU'IL NE FALLAIT PAS OUBLIER!)
Ces deux participations (NMDA et SNAS) font partie des transformations dites d'adaptations neuronales mieux définies sous le vocable de plasticité neuronale. En fait, de nombreux autres changements à la fois anatomiques, physiologiques, électrophysiologiques et biochimiques sont observables lorsque les événements de plasticité neuronale surviennent. Les pages qui suivent en décrivent un certain nombre.
154 - Processus de régénération: caractéristiques et constituants de la membrane neuronale jeune
Lorsque le processus de régénération axonale multifocale se met en branle, les brèches sont refermées progressivement dans toutes les régions lésées. Au moment où surviennent ces réparations apparaissent "quelques inégalités" au niveau des surfaces membranaires reconstruites, anodines au premier regard de la dimension microscopique. On pourrait être porté à croire que le processus "de guérison" tire déjà à sa fin. Tout sur le plan anatomique paraît être en place pour mener à un processus de maturation sans qu'aucune répercussion électrophysiologique ne se produise. Et pourtant, dans un certain nombre de cas, il n'en est pas ainsi. Il en est même tout autrement.
Ces "quelques inégalités" sont en fait des "irrégularités" anatomiques véritables qui commencent à se manifester sous forme de repousses axonales. Ces repousses axonales qualifiés de "bourgeons de régénération" sont parfois observables en plusieurs endroits où la membrane neuronale a été lésée. Elles constituent le premier stade de la portion "régénération adaptative pathologique" du processus complexe de plasticité neuronale. A ce premier stade de bourgeons de regénération vont bientôt voir se succéder des repousses allongées, ramifiées et erratiques dont l'importance variera selon les circonstances. (Voir: LE PHENOMENE DE DESAFFERENTATION)
Tout ce processus de régénération axonale multifocale produit des membranes neuronales "jeunes" qui, dans le cas des fibres A delta, ne sont pas d'emblée enveloppées de la gaine de myéline qui les recouvre naturellement. Dans le cas des fibes C, cela pourrait paraître ne faire aucune différence à prime abord, pourtant le comportement de ces zones membranaires "nouvelles", autant pour les fibres A delta que C, sera altéré comme il sera présenté ultérieurement. Dans le cas des fibres A delta, celles-ci se retrouvent donc "non protégées" en comparaison avec leur situation habituelle. Il en sera ainsi pour les autres fibres A alpha et A bêta lorsqu'elles vivent des processus de régénération semblables.
Pour expliquer en partie le comportement électrique altéré de ces membranes neuronales "toutes jeunes", il importe de préciser qu'elles contiennent, dès leur reconstruction, plusieurs complexes protéiques que l'on retrouve comme faisant partie intégrante de leur constitution en situation anatomique normale. Ainsi, elles sont munies:
- des récepteurs alpha-adrénergiques,
-
des canaux sodiques
de même que - des canaux calciques.
C'est ainsi que le début des douleurs "infernales" vient parfois de commencer (le début du commencement, pourrait-on dire!) avec ce qui aurait n'être qu'un processus de guérison de dimension physiologique mais qui en fait devient rapidement un processus de guérison "pathologique".
Lorsque le processus de régénération axonale multifocale se met en branle, les brèches sont refermées progressivement dans toutes les régions lésées. Au moment où surviennent ces réparations apparaissent "quelques inégalités" au niveau des surfaces membranaires reconstruites, anodines au premier regard de la dimension microscopique. On pourrait être porté à croire que le processus "de guérison" tire déjà à sa fin. Tout sur le plan anatomique paraît être en place pour mener à un processus de maturation sans qu'aucune répercussion électrophysiologique ne se produise. Et pourtant, dans un certain nombre de cas, il n'en est pas ainsi. Il en est même tout autrement.
Ces "quelques inégalités" sont en fait des "irrégularités" anatomiques véritables qui commencent à se manifester sous forme de repousses axonales. Ces repousses axonales qualifiés de "bourgeons de régénération" sont parfois observables en plusieurs endroits où la membrane neuronale a été lésée. Elles constituent le premier stade de la portion "régénération adaptative pathologique" du processus complexe de plasticité neuronale. A ce premier stade de bourgeons de regénération vont bientôt voir se succéder des repousses allongées, ramifiées et erratiques dont l'importance variera selon les circonstances. (Voir: LE PHENOMENE DE DESAFFERENTATION)
Tout ce processus de régénération axonale multifocale produit des membranes neuronales "jeunes" qui, dans le cas des fibres A delta, ne sont pas d'emblée enveloppées de la gaine de myéline qui les recouvre naturellement. Dans le cas des fibes C, cela pourrait paraître ne faire aucune différence à prime abord, pourtant le comportement de ces zones membranaires "nouvelles", autant pour les fibres A delta que C, sera altéré comme il sera présenté ultérieurement. Dans le cas des fibres A delta, celles-ci se retrouvent donc "non protégées" en comparaison avec leur situation habituelle. Il en sera ainsi pour les autres fibres A alpha et A bêta lorsqu'elles vivent des processus de régénération semblables.
Pour expliquer en partie le comportement électrique altéré de ces membranes neuronales "toutes jeunes", il importe de préciser qu'elles contiennent, dès leur reconstruction, plusieurs complexes protéiques que l'on retrouve comme faisant partie intégrante de leur constitution en situation anatomique normale. Ainsi, elles sont munies:
- des récepteurs alpha-adrénergiques,
-
des canaux sodiques
de même que - des canaux calciques.
C'est ainsi que le début des douleurs "infernales" vient parfois de commencer (le début du commencement, pourrait-on dire!) avec ce qui aurait n'être qu'un processus de guérison de dimension physiologique mais qui en fait devient rapidement un processus de guérison "pathologique".
155 - Processus de régénération: propriétés électrophysiologiques des bourgeons axonaux de régénération
Les membranes jeunes "toute nouvellement formées" présentent un comportement d'instabilité électrique considérable sur toute leur étendue. Ainsi, des phénomènes de dépolarisation deviennent observables pratiquement en tous points au niveau des brèches fermées et des bourgeons de régénération. Cette dépolarisation se fait de façon anarchique et mène alors à la création d'influx nociceptifs nombreux qui se présentent de façon tout aussi anarchique et erratique.
Plusieurs propriétés peuvent être observées au niveau des brèches réparées et des excroissances axonales ou bourgeons de regénération. Quatre de celles-ci nous permettent de mieux comprendre la complexité clinique des douleurs neurogènes, en particulier le caractère paroxystique ou "en salves".
Premièrement, témoin de la grande instabilité électrique et donc d'une grande excitabilité, ces bourgeons de régénération en arrivent à se dépolariser "en apparence spontanément", générant ainsi des salves d'influx qui surviennent par paroxysmes.
Ces salves d'influx, ayant pris naissance dans les portions "lésée" et dans les portions nouvellement "réparées" des fibres nociceptives C et A delta acheminent donc vers le cerveau, i.e. en DIRECTION AFFERENTE, des messages douloureux.
Ces événements de dépolarisation spontanée "ectopique" sont en fait analogues à des phénomènes d'épilepsie motrice à la différence qu'ils se produisent dans une fibre sensorielle nociceptive i.e. en direction "afférente". Dans le cas de l'épilepsie motrice classique, les phénomènes de dépolarisation se produisent dans une zone cicatricielle du cortex moteur pour être acheminés, à partir du cerveau, par les fibres motrices vers la périphérie i.e. en DIRECTION EFFERENTE.
Dans le cas de l'épilepsie motrice, le phénomène sous-jacent peut se résumer ainsi:
- dépolarisation "en apparence spontanée" d'une population de neurones du cortex cérébral moteur ---> influx acheminés le long des neurones moteurs vers la périphérie (EFFERENCES MOTRICES) ---> avalanche d'activités motrices incontrôlables en périphérie.
Dans le cas présent, un phénomène réciproque ou inverse se produit:
- dépolarisation "en apparence spontanée" trouvant origine dans des portions de membranes nouvellement réparées ou nouvellement formées appartenant à des fibres C ou A delta nociceptives (brèches et bourgeons de régénération) ---> influx acheminés le long des neurones nociceptifs vers le cerveau (AFFERENCES NOCICEPTIVES) ---> avalanche de messages douloureux comparable à une crise "d'épilepsie nociceptive" mais parvenant cette fois-ci au cerveau et non pas provenant de celui-ci.
Cette analogie est si juste que le traitement pharmacologique proposé pour les douleurs neurogènes paroxystiques repose particulièrement sur l'emploi d'anticonvulsivants et de stabilisateurs de membranes, comme on le verra dans le manuel III portant sur la gestion de la douleur avec les co-analgésiques.
Deuxièmement, les zones membranaires récemment réparées et celles en croissance (repousses, bourgeons, projections, ramifications ou excroissances) sont extrêmement sensibles aux stimuli mécaniques. Tout mouvement ou toute variation de tension mécanique dans leur environnement a pour effet d'accentuer considérablement les phénomènes de dépolarisation déjà facilement produisibles au point d'être parfois "d'apparence spontanée". Ainsi peut-on mieux comprendre, à titre d'exemple, pourquoi les personnes porteuses d'une plexopathie brachiale, attribuable à un envahissement néoplasique ou consécutive à une radiothérapie, ont tendance à positionner leur bras dans une attitude antalgique figée. Le bras se trouve habituellement appuyé contre le thorax, l'avant bras est fléchi et accolé à la paroi abdominale. Tout mouvement du bras, spontané ou imposé, déclenche des douleurs très intenses qui tardent souvent à disparaître une fois le déclenchement accompli.
Troisièmement, ces mêmes zones membranaires sont également extrêmement sensibles à toute stimulation adrénergique. Or, il existe toujours une certaine participation autonome sympathique dans toute douleur le moindrement accentuée qu'elle soit nociceptive ou neurogène.
Cette propriété de sensibilité accrue à toute stimulation adrénergique est probablement en cause dans la pathophysiologie de base du quatrième type de douleur neurogène décrit dans la classification simplifiée proposée, le syndrome régional complexe avec participation sympathique "sympathetically maintained pain" autrefois appelé dystrophie sympathique réflexe.
On peut imaginer, dans ces circonstances, que tout phénomène de tension, stress, angoisse, irritabilité voire manque de sommeil puisse avoir pour effet, à cause de la relâche accentuée qu'il entraîne à la fois de catécholamines circulantes et de neurotransmetteurs adrénergiques, d'augmenter l'excitabilité membranaire des membranes nouvellement regénérées et donc de faciliter encore plus les dépolarisations spontanées et la production d'influx nociceptifs ectopiques.
Quatrièmement, les zones membranaires regénérées peuvent être subdivisés en diverses sous-populations selon la valeur de leur seuil d'activation. Ainsi, certains sous-segments membranaires, réparties dans les zones de régénération, se dépolariseront au moindre stimulus alors que d'autres sous-populations vont nécessiter un stimulus un peu plus important pour ce faire. En outre, on observe des variations semblables quant aux seuils d'activation dans les zones de dépolarisations dites spontanées.
Cette dernière propriété contribue pour une certaine part à expliquer les résultats décevants voire même certains échecs thérapeutiques concernant la gestion de certaines douleurs neurogènes avec les co-analgésiques et cela malgré le fait:
- d'une bonne connaissance des bases pathophysiologiques des douleurs,
-
d'une évaluation fondée sur cette connaissance
et - d'un choix thérapeutique éclairé concernant les co-analgésiques.
Une part de ces échecs pourrait s'expliquer par le fait
-
que l'abaissement du seuil d'activation soit devenu tellement marqué que toute dépolarisation même très légère permette déjà d'atteindre le seuil d'activation nécessaire à la création d'un influx et cela même en présence de médicaments sensés réduire l'instabilité électrique,
- que certaines sous-populations de bourgeons soient tellement isolées dans un environnement "imperméable" de tissu fibreux cicatriciel qu'aucune concentration plasmatique, même lorsque suffisamment élevés pour créer des effets secondaires systémiques, ne puisse amener une concentration locale "thérapeutique" suffisante pour bloquer la dépolarisation spontanée.
Le Manuel III de cette série, portant sur la gestion de la douleur avec les co-analgésiques, discutera plus en détail de ces phénomènes.
156 - Les canaux sodiques et calciques: pourquoi tant d'insistance ?
Pourquoi, en parlant du processus de régénération et des caractéristiques et constituants de la membrane neuronale jeune autant d'insistance sur les canaux sodiques et calciques? Pour une raison fort simple: ils jouent un rôle prépondérant dans l'ensemble des phénomènes de dépolarisation cellulaire et de production des influx nociceptifs dans le cas présent.
À l'état normal, toute cellule vivante est polarisée, c'est-à-dire qu'elle possède une charge positive à l'extérieur parce que la concentration en ions sodiques, Na+, est plus élevée à l'extérieur de la cellule que celle des ions potassiques, K+, qui se retrouvent pour leur part en plus grande concentration à l'intérieur de la cellule.
Quand survient une stimulation sur la membrane neuronale, certains canaux ioniques, les canaux sodiques en l'occurence, commencent à s'ouvrir pour laisser entrer le Na+ à l'intérieur de la cellule, ce qui change lentement le potentiel trans-membranaire vers des valeurs "moins" négatives. A partir d'un certain niveau de dépolarisation correspondant au seuil d'activation, par exemple après être passé de - 70 mV à - 40 mV, d'autres canaux sodiques, calciques et potassiques, ceux-ci "voltage-dépendant", s'ouvrent "soudainement" tout grand. Cette ouverture "soudaine" a pour effet de laisser entrer une abondance de nouveaux ions Na+ mais surtout une très grande abondance d'ions Ca++. Une dépolarisation massive et soudaine responsable d'un changement "instantané" de polarisation se produit. Cette dépolarisation massive et soudaine occasionne la production d'un influx électrique qui se propage alors dans la fibre. L'influx ou le courant électrique ainsi créé dans une fibre nociceptive transporte une information nociceptive qui sera interprétée par le cerveau comme un message douloureux puisqu'il aboutira dans des régions du tronc cérébral et du cerveau responsables de la réception et de l'interprétation des messages nociceptifs. On appelle ces influx nociceptifs des "afférences nociceptives".
Dans les microsecondes qui ont suivi la création d'un influx, la polarisation i.e. le potentiel trans-membranaire de la cellule s'est retrouvé fortement inversée: l'intérieur de la cellule est devenu chargé positivement, l'extérieur négativement. Il faudra par la suite un retour à la polarisation "normale" i.e. une repolarisation avant que de nouveaux influx puisssent être créés. Cette repolarisation se fera par l'ouverture d'autres canaux qui permettront aux différents ions impliqués (surtout Na+, Ca++ et K+) de retourner à leur position de départ. C'est ainsi que vont s'ouvrir tout particulièrement des canaux potassiques pour faire sortir le surplus d'ions potassiques, K+, de la cellule afin de rétablir le potentiel transmembranaire de repos. Durant un bref moment, le potentiel transmembranaire deviendra même trop "négatif" avant de retourner à ses valeurs de potentiel de repos, ce sera la courte phase d'hyperpolarisation.
Plus le phénomène de dépolarisation spontanée est intense et répété, plus le cerveau reçoit de messages douloureux c'est-à-dire "d'afférences nociceptives" et plus l'intensité des douleurs s'accentue.
(Voir: LE PHENOMENE DE DEPOLARISATION "MEMBRANAIRE" ET LE SEUIL D'ACTIVATION / LES DIFFERENTS "CANAUX IONIQUES" / LE PHENOMENE D'HYPERPOLARISATION "MEMBRANAIRE")
157 - Plasticité: les conséquences structurelles
Les changements rapportés jusqu'à maintenant se sont attardés surtout à décrire les événements survenant au niveau membranaire suite à des situations d'agression sur le réseau nociceptif périphérique. Les conséquences attribuables aux lésions subies par les fibres nerveuses nociceptives sont loin de se limiter aux changements décrits jusqu'à maintenant. En fait, les changements regroupés sous le concept de plasticité touchent de nombreuses facettes autant structurelles, biochimiques qu'électrophysiologiques. Différentes structures cellulaires participent aux phénomènes "d'adaptation pathologique", plus élégamment appelé "phénomènes de plasticité neuronale", menant aux douleurs difficiles à contrôler et responsables pour une part de la chronicisation des douleurs.
Ainsi, plusieurs cellules contribuent de façon déterminante aux processus de plasticité. Parmi ces cellules on retrouve:
-
des cellules neuronales non nociceptives telles les cellules gliales normalement présentes au niveau du tissu nerveux et en l'occurence au niveau de la corne postérieure, soient
- les astrocytes,
- les oligodendrocytes
- les cellules microgliales immunocompétentes
-
et
- des cellules non neuronales telles les cellules T immunocompétentes (lymphocytes T) reconnues pour infiltrer la corne postérieure suite à des agressions tissulaires loco-régionales exercées directement au niveau de la moelle ou sur les neurones sensoriels et donc nociceptifs périphériques.
158 - Plasticité: les conséquences biochimiques
-
Ces différentes cellules participent toutes à leur façon aux processus inflammatoires menant à la mise en branle de phénomène de reconstruction et aux processus de sécrétions de substances inflammatoires qui viennent perturber l'homéostasie des échanges nociceptifs.
-
Les changements regroupés sous le concept de plasticité neuronale et découlant de lésions subies par les fibres nerveuses touchent aussi la facette "environnement biochimique" en raison des nombreuses substances retrouvées lors des événements de plasticité survenant au niveau de la corne postérieure. Ces substances participent à leur tour aux phénomènes d'adaptation "pathologique" menant aux douleurs difficiles à contrôler et responsables pour une part de la chronicisation des douleurs tel que suggéré plus avant.
La contribution des cellules gliales à l'homéostasie au niveau de la corne postérieure est étonnante. Elle repose sur une modulation exercée sur différents neurotransmetteurs tant nociceptifs qu'antinociceptifs tels:
- le glutamate,
- la sP,
- l'acétylcholine,
- l'acide gamma-amino-butyrique (GABA),
- le 5-HT (sérotonine),
-
la norépinéphrine
et - l'adénosine.
Ces substances originent soit des neurones nociceptifs périphériques, soit des faisceaux inhibiteurs descendants ou soit des interneurones habitant la corne postérieure. Dans leur rôle de modulation, les cellules gliales peuvent, selon les cironnstances,
-
autant faciliter les échanges nociceptifs donc augmenter les douleurs
que - faciliter les influx inhibiteurs descendants et donc réduire les douleurs.
Les cellules gliales sont particulièrement reconnues pour accumuler en intra-cellulaire d'importantes quantités de glutamate, de GABA et de glycine. Elles peuvent de cette façon exercer leur contribution à la régulation des échanges nociceptifs (inhibition vs facilitation) au niveau de la corne postérieure. A titre d'exemple, les cellules gliales contribuent à la régulation des échanges synaptiques impliquant l'acétylcholine (ACh) en sécrétant une protéine se liant à l'ACh alors qu'elles contribuent à celles impliquant le glutamate en modifiant une sous-unité protéique composant le récepteur NMDA ce qui altère alors la réponse du récepteur NMDA aux stimulations exercées par le glutamate.
En présence d'agressions de divers types, ces différentes cellules sont alors activées de sorte que leur fonction physiologique devient perturbée. Ainsi, la corne postérieure devient infiltrée par des cellules T immunocompétentes (lymphocytes T), un des effet connu de cette infiltration sera de provoquer une perte d'intégrité dans la barrière hémo-encéphalique dans l'environnement loco-régional.
Par ailleurs, tant les cellules gliales que les lymphocytes T vont alors produire une panoplie de substances qui auront comme effet de perturber la modulation physiologique des échanges nociceptifs au niveau de la corne postérieure. Parmi les substances ainsi produites et qui se retrouvent dans l'environnement extra-cellulaire figurent:
- certaines cytokines dont des interleukines, des neurotrophines et du TNF (tissue necrosis factor),
- du monoxyde d'azote (NO),
- des prostaglandines,
- de l'histamine,
- de l'adenosine triphosphate (ATP),
-
de la glycine
et - du glutamate.
Parmi les changements observables au niveau de la corne postérieure en présence d'agression sur les fibres nociceptives, on réalise finalement que "l'entrée en activité" de certains récepteurs biochimiques situés au niveau des membranes post-synaptiques, notamment les récepteurs N-méthyl-D-aspartate (NMDA) ne représente qu'une portion seulement des "adaptations pathologiques" beaucoup plus complexes qui se déroulent à ce niveau (Voir LES RECEPTEURS NOCICEPTIFS-CLE: LES RECEPTEURS NMDA).
En fait, il se déroule de profondes perturbations biochimiques particulièrement au niveau du corps cellulaire du neurone nociceptif central (le début des faisceaux spinothalamiques et les autres) qui seront discutées ultérieurement.
159 - Plasticité: les conséquences "électrophysiologiques" centrales
À partir du moment où des foyers de dépolarisation ectopiques, provoqués ou spontanées, se manifestent au niveau des fibres nociceptives périphériques et au niveau des structures membranaires post-synaptiques apparaît le phénomène d'hyperstimulation nociceptive.
En présence d'un tel phénomène, il devient possible d'observer des changements "électrophysiologiques" de plusieurs ordres. Des activités "électriques" anormales sont non seulement observables au niveau de la corne postérieure mais ils peuvent aussi être observés à plusieurs niveaux des relais ascendants, notamment dans: (MZ 214 D P3)
- les faisceaux ascendants nociceptifs (spinothalamiques et autres),
- le thalamus,
- le cortex sensitif (pariétal).
Ces activités électriques anormales peuvent s'exprimer de diverses manières:
-
des influx commencent à se propager dans les neurones centraux avec une fréquence anormalement élevée, souvent sous forme de longues traînées d'influx qui conservent leur régularité,
- ailleurs, des salves de décharges paroxystiques spontanées de durée variable s'entremêlent à ces traînées d'influx anormalement élevées en fréquence.
Plus les lésions sont sévères et importantes, plus ces anomalies prennent de l'importance car les phénomènes "d'hyperexcitation et d'hyperexcitabilité" jouent un rôle de plus en plus marqué.
Un des éléments-clé pouvant être observé à cet égard concerne l'apparition d'activités ectopiques "spontanées" avec des fréquences anormalement élevées dans les fibres des faisceaux néo-spinothalamiques et des différentes composantes du faisceau paléo-spinothalamique particulièrement lors de leur passage au niveau des relais centraux médullaires (bulbe).
De telles décharges électriques spontanées paroxystiques avec fréquences anormalement élevées s'observent aussi au niveau du thalamus qui est le plus important relais pour les circuits nociceptifs et les autres circuits sensitifs.
Le fossé se creuse ainsi de plus en plus entre ce qui était au point de départ une stimulation soutenue d'un ensemble de nocicepteurs ou d'une zone neuronale lésée (par un processus tumoral ou par un autre type d'agression) et les douleurs qui sont maintenant éprouvée.
Plus les lésions en périphérie sont sévères, plus ces anomalies prennent de l'ampleur reflétant le fait que les changements dits de plasticité deviennent de plus en plus importants. Ces cascades de changements accompagnent les changements électrophysiologiques "d'hyperexcitation et d'hyperexcitabilité" qui ont d'abord débuté au niveau de la membrane postsynaptique et qui jouent par la suite un rôle de plus en plus marqué. Ici et toujours, les changements se produisent comme "à l'envers du bon sens". Plus les douleurs sont importantes, plus les phénomènes de plasticité contribuent à l'amplification de ces mêmes douleurs et plus elles s'intensifient. Etrange phénomène que l'inflation nociceptive dans la nature! Une pharmacologie "dédiée et rationnelle" deviendra donc ultimement nécessaire.
De tels changements électrophysiologiques sont aussi observés dans le cas où les neurones centraux deviennent le siège d'agressions mais, à ce moment, ces anomalies électrophysiologiques prendront beaucoup plus de temps, plusieurs semaines voire plusieurs mois, avant de se développer alors qu'il ne faut que quelques heures à quelques jours pour les voir apparaître dans le cas d'hyperstimulation d'origine périphérique.
Ces observations permettent de comprendre certaines réserves au sujet des blocs nerveux lytiques et des interventions neurochirurgicales quand l'espérance de vie d'une personne en phase palliative dépasse 6 à 9 mois. Après une période de trêve de quelques mois dans les douleurs, trêve découlant de ces interventions ayant eu pour effet de créer une désafférentation, pourraient apparaître de nouvelles douleurs alors pires que celles pour lesquelles ces interventions avaient été offertes (Voir Manuel V de cette série portant sur les approches non-médicamenteuses). Choix déchirants bien sûr face à des douleurs redoutables que celui de désafférenter ou non mais combien regretté lorsque les douleurs post désafférentation sont installées.
Aussi profonds puissent être les changements de plasticité découlant, à leur départ, de lésions organiques structurelles sur le réseau nociceptif, il n'en demeure pas moins qu'il ne faut cependant jamais interpréter ces explications comme une tentative de réduire le problème complexe des douleurs chroniques, sans bases organiques identifiées, à une telle simplification. D'autres mécanismes pathophysiologiques extrêmement complexes et encore mal connus se déroulent dans les méandres du réseau limbique pour faire en sorte d'amplifier les aspects "désagréments" des douleurs chroniques pour lesquels l'arsenal pharmacologique est encore réduit à presque rien. Les approches non-pharmacologiques demeurent encore les préférées dans ces circonstances.
160 - Plasticité et douleurs "mystérieuses": les répercussions cliniques des différents changements
Il se pourrait bien que plusieurs de ces altérations, à la fois nombreuses et importantes, expliquent en partie certains types de douleurs qui semblent un peu mystérieuses de prime abord:
- les douleurs d'un "membre fantôme",
- les douleurs consécutives à une cordotomie, une lyse (phénolisation) neuronale,
- ainsi que de nombreuses autres douleurs nous paraissant difficiles à expliquer et même à accepter, pour certains cliniciens, comme étant véritable!
161 - La douleur neurogène paroxystique ou "en salves": ses caractères cliniques
-
Même dans les contextes oncologiques, certaines de ces douleurs paraissaient encore douteuses à certains cliniciens jusqu'à l'arrivée d'une technique d'investigation tout à fait impressionnante qu'est la tomographie par émission de positrons ( TEP ou PET scan). Il faut avoir vu, en contexte oncologique, certains cas où le TEP montrent un imposant fardeau tumoral disséminé totalement ou presque totalement ignoré par d'autres modalités modernes d'investigation par imageries telles la Résonnance magnétique et la Scintigraphie osseuse pour croire que les douleurs signalées par les patients ... étaient bien vraies.
-
La douleur neurogène paroxystique ou "en salves" souvent comprise dans un sens large et erroné comme étant l'équivalent d'une douleur "par désafférentation" peut être due à:
-
une compression nerveuse sévère, responsable d'une instabilité électrique se manifestant par des épisodes soudains et intenses de douleurs,
-
une infiltration du tissu nerveux par des cellules néoplasiques dont la progression et la sévérité auront causé d'intenses dommages aux structures neuronales à commencer par les membranes et les microtubules responsables du transport des nutriments intracellulaires. Certains neurones pourront ainsi avoir subi un sectionnement (ils auront été déafférentés) alors que de nombreux autres neurones, malgré l'intensité de l'agression, auront réussi "à survivre" mais au prix de transformations profondes dans leur structure et dans leur stabilité électrique,
- des changements morphologiques variables au niveau des fibres nociceptives, changements cependant non reliés à la compression ou à l'infiltration tumorale mais attribuables à divers autres facteurs (diabète, chimiothérapie, chirurgie, radiothérapie, séquelles post-infection, séquelles post-traumatisme etc.).
162 - La douleur neurogène paroxystique ou "en salves": représentation schématique
-
A la différence du contexte des douleurs accompagnées, ces conditions sont, dans l'ensemble, susceptibles d'occasionner une destruction plus massive des neurones nociceptifs (... et aussi des autres neurones tant sensoriels que moteurs). Toujours à la différence des douleurs accompagnées, ces lésions n'entrainent pas d'instabilité électrique en continue au niveau des membranes lésées, l'instabilité électrique se manifeste plutôt en paroxysmes ou en salves.
Cette illustration suggère différentes représentations schématiques des douleurs neurogènes paroxystiques.
Seuls les paramètres de rythmicité, de durée et d'intensité sont illustrés. (Voir: LA DOULEUR NEUROGENE PAROXYSTIQUE OU "EN SALVES": SES CARACTERES CLINIQUES)
163 - La douleur neurogène paroxystique ou "en salves": résistance aux opiacés ???!!!
Les douleurs neurogènes sont, depuis longtemps, considérées comme difficiles à maîtriser de façon satisfaisante. On les a même qualifiées de résistantes, en partie ou en totalité, aux opiacés. Nous en avons discuté précédemment.
Ces affirmations ne sont qu'en partie fondées. C'est ici que la connaissance des mécanismes pathophysiologiques sous-tendant les divers types de douleur vient jeter un éclairage différent sur ces observations cliniques devenues, avec le temps, des affirmations au ton pessimiste et à l'allure parfois alarmiste.
On ne devrait pas, en effet, se contenter d'affirmer ou de soutenir que certaines douleurs neurogéniques résistent aux opiacés. On doit plutôt se rendre à l'évidence de l'illogisme d'utiliser des opiacés contre des douleurs paroxystiques qui sont des douleurs du "tout ou rien" tel que décrit précédemment. Puisque ces douleurs tirent leur origine d'une équivalence avec les mécanismes épileptiformes, il paraît alors aussi illogique d'utiliser des opiacés pour ce type de douleur qu'il aurait été illogique d'utiliser des opiacés dans le traitement d'une épilepsie motrice.
Le fait que cette douleur soit totalement absente en dehors des épisodes paroxystiques rend difficile, pour ne pas dire impossible, d'en arriver à un ajustement posologique adéquat avec les opiacés. En effet, il est impossible d'élaborer un ajustement posologique quand la douleur est totalement absente en espérant "en prime" que cet ajustement permettra de soulager les accès douloureux imprévisibles. Tenter un tel exercice est totalement futile.
Même plus, une telle démarche est illogique, irrespectueuse des principes de pharmacocinétique et ne cadre pas avec une pharmacothérapie rationnelle, sans compter qu'elle comporte l'emploi de substances ayant des demi-vies de quelques heures contre des accès de douleur ne durant parfois que quelques secondes à quelques minutes. En contre-partie, l'usage d'opiacés à longue action soumet le patient à l'effet d'opiacés de façon soutenue alors que les douleurs ne peuvent se produire qu'à quelques reprises durant la journée.
Enfin, l'emploi de doses élevées d'opiacés nécessaires pour maîtriser l'intensité élevée de ces douleurs paroxystiques entraînera à coup sûr tout un cortège d'effets secondaires sérieux et nettement "inutiles".
Décidément les opiacés n'ont ni les propriétés ni les capacités de s'adresser à la pathophysiologie des douleurs neurogènes paroxystiques. Voilà comment il faut comprendre ce mauvais mariage. Ce n'est donc plus en fait un problème de douleurs qui résistent aux opiacés mais un problème d'emploi non justifié d'une substance pharmacologique en regard d'une pathophysiologie spécifique menant à un type particulier de douleur.
Face à une douleur, il faut donc, à chaque fois, tenter de s'adresser à la pathophysiologie de la douleur en faisant les choix les plus appropriés possible en regard de l'arsenal pharmacologique afin de mener au meilleur traitement possible. Il en est de même dans les choix des différentes modalités d'approche s'adressant à la douleur globale, il faut, autant que faire se peut, viser une composante bien identifiée de la douleur globale. Chaque fois donc, il faut s'adresser à une composante pathophysiologique plutôt que de s'adresser à la douleur comme un symptôme "mal définissable" ou "mal défini".
164 - Les douleurs neurogènes ultra simplifiées: quatre facteurs pour une certaine logique séquentielle
En fait, dans le but de vouloir simplifier pour la compréhension, des phénomènes forts complexes, on pourrait imaginer que certaines caractéristiques cliniques propres aux douleurs neurogènes puissent découler à la fois de la façon dont le tissu néoplasique évolue et infiltre progressivement le tissu nerveux et à la fois de certaines propriétés anatomophysiologiques propres aux divers types d'axones touchés. Ainsi, la différence entre la douleur neurogène simple, accompagnée (paresthésie / dysesthésie) et paroxystique puisse fort bien tenir essentiellement à la combinaison des quatre facteurs suivants:
- le type de fibre et/ou de nocicepteur touchés
- le degré d'atteinte
-
le phénomène de multi-convergence
et - l'activation des récepteurs NMDA.
A titre d'exemple,
-
la qualité des douleurs ressenties au niveau cutané inclut deux grands types de sensations: un engourdissement / fourmillement et une brûlure. Les enregistrements microneurographiques démontrent que la stimulation des fibres A delta se traduit préférentiellement par une douleur -"engourdissement" alors que celle des fibres C provoque une douleur -"brûlure".
-
le degré d'atteinte des fibres nerveuses, dans le contexte d'une masse tumorale en évolution, peut découler d'une compression pouvant varier de légère à sévère ou encore d'une infiltration qui est un degré comme plus avancé de l'agression tumorale. Lorsque suffisamment sévère, cette agression (compression sévère ou infiltration marquée) peut aboutir à de la nécrose neuronale et donc au sectionnement d'un certain nombre de fibres nociceptives en divers endroits du champ tumoral.
Ainsi, la compression de fibres A delta pourra occasionner dans une région donnée une douleur accompagnée (paresthésie / dysesthésie) de type "engourdissement" alors que cette même compression sur des fibres C pourra occasionner une douleur-brûlure. Le phénomène d'infiltration ne pourra qu'aggraver ces deux types de douleur. Par ailleurs, une compression sévère combinée ou non à de l'infiltration pourra avoir occasionné le sectionnement d'un certain nombre de fibres C ou A delta et avoir ainsi entraîné des douleurs d'un autre type soient des douleurs paroxystiques ressenties comme des "chocs électriques".
-
par ailleurs, plus les lésions sur le réseau nerveux sont sévères, plus il y a de fibres périphériques de touchées (C, A delta, A bêta), plus les neurones centraux sont soumis à des stimulations inhabituelles et exagérées de la part des fibres nociceptives et en contrepartie inhabituelles et de plus en plus inopérantes de la part des fibres modulatrices A bêta, plus le phénomène de multi-convergence s'exerce dans la déroute avec des influx principalement anormaux de toute part.
- enfin, plus les fibres nociceptives émettent de stimulations inhabituelles et exagérées, plus les récepteurs NMDA deviennent activés et plus importantes deviennent les douleurs.
Dans ces circonstances, la douleur d'abord ressentie comme douleur simple (douleur "douleur") est susceptible de passer à douleur accompagnée et par la suite à douleurs paroxystiques. C'est le risque d'un processus tumoral en évolution. Ainsi, dans cet enchevêtrement de mécanismes pathophysiologiques complexes à plusieurs niveaux, il semble possible de dégager une certaine rationalité, encore très incomplète et imprécise bien sûr mais plus éclairante quand même et surtout guidante pour la thérapeutique à appliquer.
Il est entendu que les explications qui précèdent concernant le type et le degré d'agression (compression, infiltration, sectionnement) s'appliquent autant aux fibres nociceptives du système somatique qu'à celles du système autonome innervant les viscères.
165 - Les douleurs neurogènes ultra simplifiées: une certaine logique séquentielle avec l'évolution néoplasique
Certaines caractéristiques cliniques propres aux douleurs neurogènes peuvent découler à la fois de la façon dont le tissu néoplasique évolue et infiltre progressivement le tissu nerveux et à la fois de certaines propriétés anatomophysiologiques propres aux divers types d'axones touchés.
Ainsi, la compression relativement importante de fibres A delta pourra occasionner une douleur accompagnée (paresthésie / dysesthésie) de type "engourdissement" alors que cette même compression sur des fibres C pourra occasionner une douleur-brûlure.
Cette même compression, combinée à de l'infiltration qui aurait déjà produit, dans un secteur voisin, le sectionnement d'un certain nombre de fibres C ou A delta, pourra entraîner des douleurs d'un autre type, par exemple des paroxysmes en "choc électrique".
166 - Une certaine logique séquentielle avec l'évolution néoplasique: applicable au réseau somatique et autonome
Il est entendu que les explications qui précèdent concernant le type et le degré d'agression (compression, infiltration, sectionnement) s'appliquent autant aux fibres nociceptives du système somatique qu'à celles du système autonome innervant les viscères.
167 - Les douleurs ténesmoïdes: deux types
Compte tenu des différents phénomènes décrits précédemment, on peut alors comprendre que des douleurs décrites comme ténesmoïdes puissent être en fait des douleurs neurogènes paroxystiques. Il est en effet possible de considérer les douleurs "ténesmoïdes" selon deux mécanismes pathophysiologiques fondamentalement différents.
En premier lieu, la définition de base consiste à considérer ces douleurs comme résultant d'une suite de contractions plus ou moins importantes des muscles lisses d'un viscère donné. Ainsi, en présence d'une infection aiguë de la vessie ou en présence d'une infiltration de la paroi vésicale par une masse néoplasique, des douleurs profondes, au niveau du bas ventre, résultant de contractions vésicales, pourraient être ressenties. Ces douleurs seraient qualifiées d'authentique ténesme vésical, puisqu'en fait, elles résultent véritablement de contractions musculaires vésicales.
En deuxième lieu, il est cependant possible qu'une personne puisse ressentir ce même type de douleur profonde au bas ventre, ressemblant en tout point à du ténesme vésical, alors que la vessie a pu être enlevée comme traitement d'un cancer de la vessie. Comment alors expliquer ces douleurs ténesmoïdes alors qu'il n'existe plus de muscle vésical? L'explication en est fort simple. Lors de la cystectomie, les fibres sensitives innervant la vessie ont été sectionnées. La suite de ces sectionnements est maintenant bien connue ... tentative de régénération par des excroissances neuronales, zones de dépolarisations spontanées erratiques imbriquées dans des accumulations plus ou moins importantes de dépôts fibrotiques, apparition de flambées de décharges dans certains bourgeons de régénérescence et finalement, arrivée d'influx douloureux au cerveau. Ces informations "nociceptives", provenant de l'extrémité des fibres nociceptives qui "autrefois" innervaient la vessie offrent véritablement un caractère "ténesmoïde" aux douleurs ressenties. Un tel caractère pourrait être ressenti "dans le rectum" si les fibres lésées se retrouvaient dans la région rectale ou péri-rectale.
On se doit donc de distinguer la douleur ténesmoïde "musculaire" de la douleur ténesmoïde "neurogène" avant de choisir un traitement. Encore une fois, une meilleure compréhension des mécanismes douloureux augmente les chances d'obtenir une meilleure gestion analgésique.
Voilà donc encore un autre exemple de la nécessité
- de comprendre les mécanismes pathophysiologiques avant d'évaluer les douleurs,
- de s'adresser, par le traitement, aux mécanismes pathophysiologiques plutôt qu'à la douleur elle-même.
Tout choix thérapeutique éclairé repose d'abord et avant tout sur la reconnaissance des mécanismes pathophysiologiques en cause.
168 - Les douleurs compliquées d'une participation "soutenue" du système nerveux autonome sympathique
Autrefois appelée dystrophie sympathique réflexe ou causalgie, les douleurs compliquées d'une participation du système nerveux autonome sympathique ou "sympathetically maintained pain" sont des douleurs dans lesquelles l'activité du système nerveux autonome sympathique joue un rôle clé. Cette participation peut cependant se faire à divers degrés. Il arrive souvent que ce ne soit que lorsque le degré de participation sympathique est avancé que l'on reconnaisse cet état de fait, le diagnostic de cette participation demeurant alors insoupçonné pendant relativement longtemps.
En situation physiologique normale, l'activité sympathique ne possède aucun effet sur les nocicepteurs alors que l'activation des nocicepteurs induit pour sa part une accentuation des influx sympathiques dans les dermatomes où les nocicepteurs sont activés. Bien que les douleurs compliquées d'une participation "soutenue" du système nerveux autonome sympathique ("sympathetically maintained pain") ne soient encore qu'incomplètement définies, ce syndrome peut être compris comme une prise de contrôle des nocicepteurs par le système sympathique devenu hyperactif dans certaines régions. En fait, tout se déroule comme si le système nerveux sympathique prenait le contrôle de l'activité algésique dans une région donnée, avec en même temps, des conséquences à deux niveaux:
-
au niveau des régions synaptiques de la corne postérieure, l'hyperstimulation sympathique augmente le nombre d'influx nociceptifs y arrivant avec des conséquences déroutantes sur la multi-convergence puisque les fibres centrales (les WDR) voient leurs stimulations devenir erratiques et s'amplifier de façon extrêmement importante et tout aussi déroutantes sur les NMDA puisque l'augmentation du nombre d'influx arrivant sur les fibres centrales entraîne le "réveil" i.e. l'activation des récepteurs NMDA.
- au niveau vasculaire, l'hyperactivité adrénergique produit de l'ischémie locale avec ses conséquences ultérieures soit inflammation et plus tard fibrose tissulaire. Cette ischémie locale provient de l'alternance répétée de vasoconstriction soutenue commandée par l'hyperactivité sympathique à laquelle fait suite une vasodilatation secondaire découlant de l'ischémie focale devenu tellement importante que les différentes structures sous gouverne du SNAS ne peuvent plus répondre à l'hyperstimulation sympathique. Ces alternances répétées de vasonconstriction/vasodilatation sont responsables de l'apparition de nombreuses substances inflammatoires et algogènes qui entraînent à leur tour la sensibilisation de milliers, voire de millions de nocicepteurs présents dans la région ischémique.
L'hyperactivité du système nerveux sympathique joue un rôle tellement important dans les mécanismes pathophysiologiques des douleurs compliquées d'une participation du système nerveux autonome sympathique ou "sympathetically maintained pain" qu'une bonne part du traitement visera à tenter de bloquer cette hyperactivité.
Etrange pathophysiologie, s'il en est une. A première vue, on a donc l'impression que le message douloureux AFFERENT (de la périphérie vers la région centrale), transporté par les fibres nociceptives, aurait pu déclencher une réponse réflexe EFFERENTE (de la région centrale vers la périphérie) du système nerveux autonome dans le ou les mêmes dermatomes où la douleur est perçue et "garder le contrôle" de cette réponse réflexe. C'est en fait ce qui se produit pour le déclenchement mais c'est probablement le contraire pour le contrôle. Cette réponse EFFERENTE du système nerveux autonome se comporte un peu comme si elle allait prendre le contrôle de la douleur, le phénomène de douleur sous gouverne du SNAS devenant pratiquement "autosuffisant et autodéclenchant" puisque c'est alors le SNAS qui prend la gouverne des nocicepteurs, causant de cette manière un cercle vicieux qui ne va souvent qu'en s'amplifiant.
Chez les personnes atteintes de cancer, cette hyperactivité "idiopathique", dans un ou des dermatomes où des lésions nerveuses ont déjà été produites, pourrait bien être, à l'occasion, le tout premier signe avant-coureur du subtil processus d'infiltration tumorale y prenant place.
169 - Les douleurs compliquèes d'une participation "soutenue" du système autonome sympathique: les manifestations cliniques
Sur le plan clinique, les douleurs compliquées d'une participation du système nerveux autonome sympathique ou "sympathetically maintained pain" se manifestent par des anomalies autonomiques multiples dans une région où généralement de la douleur est éprouvée. Cette participation et ces manifestations peuvent se faire à des degrés divers comme proposé antérieurement.
Les symptômes suivants peuvent ainsi apparaître sur un fond de douleur modérée ou intense:
-
des changements vasomoteurs s'étalant d'une pâleur excessive à une hyperémie marquée. La pâleur excessive provient de régions de vasoconstriction intense, l'hyperémie marquée, parfois accompagnée de zones violacées, témoigne de l'ischémie intense provoquée par les alternances de vasoconstriction et de vasodilatation ischémique réflexe;
-
de l'oedème traduisant l'importante réaction inflammatoire "cutanée" déclenchée par les changements séquentiels fluctuants de vasoconstriction soutenue et de vasodilatation ischémique réflexe;
-
des anomalies de la transpiration aussi reliées à l'hyperactivité du système sympathique et à la vasoconstriction qui en découle;
- enfin, des changements trophiques tels que la perte de pilosité et l'apparition de plaques cutanées indurées qualifiées de "peau cartonnée" et même la chute des ongles quand l'hyperactivité sympathique touche la matrice de l'ongle au niveau des extrémités.
170 - La douleur neurogène: symptôme de présentation
Durant l'évolution d'un cancer, le tissu nerveux est souvent touché. Il n'est donc pas surprenant que les patients rapportent des douleurs. Ces douleurs, la plupart du temps en progression, sont souvent présentes depuis longtemps. En fait, la douleur figure même très souvent parmi les premiers symptômes cliniques, bien avant qu'un diagnostic de cancer ne soit établi. Des études cliniques ont démontré que la douleur "DOULEUR" i.e. la douleur neurogénique simple constitue le symptôme de présentation dans 75 à 90 % des cas lors de lésions au tissu nerveux.
Par ordre décroissant, les douleurs accompagnées (paresthésie / dysesthésie) de tous types viennent au deuxième rang tandis que les paresthésies "pures" i.e. les paresthésies sans douleur occupent la troisième place.
Ce n'est souvent que plusieurs semaines à plusieurs mois plus tard qu'une faiblesse apparaît dans une région où de la douleur s'était pourtant manifestée bien avant.
Il est regrettable, pour plusieurs patients, que le cancer ait eu le temps d'évoluer bien au delà de ses premiers stages, quand la douleur n'était que le seul et unique symptôme de présentation, avant qu'il ne devienne possible d'en établir correctement le diagnostic. Les soupçons d'un diagnostic de cancer avec atteinte neurogène ne figure pas parmi les premiers diagnostics différentiels du clinicien oeuvrant en dehors du champ spécifique de l'oncologie ou des soins palliatifs, qu'il soit généraliste ou spécialiste. Par ailleurs, des résultats normaux provenant de l'examen neurologique et de l'imagerie radiologique de base souvent demandée ont tendance à faussement rassurer ce même clinicien. Il faut reconnaître que les cliniciens n'ont pas été habitués à penser en terme de signification particulière pour une douleur nouvelle puisque la douleur ne fait pratiquement partie d'aucun curriculum de formation dans de nombreuses facultés de médecine.
Ceci étant dit, il peut, en effet, être souvent difficile d'établir un diagnostic quand la douleur n'est que le seul symptôme mais si au moins il avait été possible "d'entendre" ce qu'une douleur pouvait signifier. Le délai est d'autant plus regrettable quand c'est carrément la Tomographie par émission de positrons (TEP scan) ou encorre l'autopsie qui viennent finalement confirmer que les douleurs avaient de réelles raisons d'être et que la personne disait bien vrai.
Il faudrait toujours penser la douleur en accord avec le principe suivant: la douleur est telle que les gens la décrivent et non pas telle que "JE" pense qu'elle est.
En somme, le diagnostic d'une douleur comme "nouveau symptôme" ne devrait pas reposer uniquement sur un examen neurologique (le plus souvent rassurant parce que les réflexes sont normaux!) et l'emploi d'appareils d'investigation mais, pour une bonne part, sur
- un questionnaire "éclairé",
-
un haut niveau de suspicion
et - un suivi très serré.
171 - La douleur neurogène: diagnostic différentiel anatomique
Le diagnostic des douleurs neurogènes, non pas pour le type de douleur mais pour la localisation des lésions, pose souvent problème. Cela est dû au fait que les repères anatomiques, d'où ces douleurs pourraient trouver origine, sont souvent confondants, si bien que le diagnostic différentiel entre plexopathie, radiculopathie et lésions touchant le rachis, c'est-à-dire les vertèbres, les lames, les articulations inter-apophysaires et les ligaments ou lésions extra-rachidiennes mais péri plexus ou racine n'est pas toujours facile à établir.
La première question qui devrait alors se poser est la suivante:
Quelle structure atteinte peut expliquer la douleur de ce patient?
-
- un nerf?
-
une partie d'un plexus?
ou - une racine?
La deuxième question étant la suivante:
Où le tissu tumoral se trouve-t-il pour expliquer les douleurs, s'agit-il d'un envahissement?
-
-
rachidien (ou vertébral)?
ou - non rachidien?
-
rachidien (ou vertébral)?
La troisième question se posant comme suit:
-
S'agit-il d'une douleur?
-
-
irradiée?
ou - référée?
-
irradiée?
(Voir: EPARPILLEMENT MULTI-ETAGE, MULTI-CONVERGENCE, DOULEUR IRRADIEE ET DOULEUR REFEREE)
172 - Les neuropathies
Dans le cas des personnes atteintes de cancer, il est généralement assez facile de soupçonner un diagnostic de douleur neurogène par neuropathie, étant donné la zone de distribution assez bien circonscrite de la douleur, moins souvent évocatrice d'une plexopathie, d'une monoradiculopathie ou d'une polyradiculopathie.
Le défi diagnostique se présente lorsque des douleurs sont ressenties dans plusieurs régions d'une même zone de distribution anatomique, par exemple, des douleurs dans différentes régions d'un membre. Le diagnostic différentiel qui se pose alors est le suivant:
- polyneuropathie?
- plexopathie?
- mono ou polyradiculopathie?
- et même ... métastases osseuses qui n'ont pourtant rien à voir avec les douleurs neurogènes mais qui peuvent quand même être ressentie en divers endroits d'une même zone de distribution anatomique.
Ici, l'EMG peut s'avérer utile pour aider à répondre à ces questions.
On doit aussi se rappeler qu'il est possible, même en présence de cancer, que les douleurs soient attribuables à des causes non-néoplasiques comme le diabète, les effets post-chimiothérapie, une hernie discale. Les douleurs pourraient aussi découler d'un phénomène para-néoplasique et non pas d'un phénomène direct causé par une compression, une infiltration ou un sectionnement.
173 - Les plexopathies
La douleur neurogène par plexopathie est plus difficile à diagnostiquer que la précédente. Cependant, la présence de tissu tumoral à proximité du plexus, lorsqu'elle est connue, peut grandement aider au diagnostic, surtout lorsqu'on réussit à combiner cette information avec la ou les localisations des douleurs ressenties. En fait, ces informations anatomiques pouvant provenir d'images radiologiques ou d'une chirurgie sont loin d'être toujours disponibles, dans le cas des personnes évaluées pour douleur avant que le diagnostic de cancer ne soit posé.
A titre d'exemple, la douleur disséminée en zones éparses dans un membre peut difficilement être attribuable à une mononeuropathie, voire à une polyneuropathie qui ne toucherait qu'un seul membre. Elle peut, par contre, être plus logiquement attribuée à une plexopathie surtout quand la présence de tissu tumoral dans le voisinage immédiat du plexus est connue.
Si le diagnostic de plexopathie est écarté, on doit sérieusement songer à une radiculopathie (mono ou poly) imputable à un envahissement tumoral extra-rachidien (masse néoplasique para-rachidienne ou para-vertébrale envahissant ou non les trous de conjugaisons) ou intra-rachidien (masse néoplasique dans le canal dural envahissant ou non le canal dural).
Là encore, l'EMG peut aider, si disponible.
174 - Les différents plexus: deux grandes familles
De toute évidence, le diagnostic de plexopathie suppose que l'on connaisse adéquatement les différents plexus car il s'agit probablement du diagnostic le plus difficile à établir dans le cas des douleurs neurogènes en contexte de soins palliatifs "oncologiques".
Les plexus se divisent en deux grandes familles:
-
les PLEXUS SOMATIQUES
et - les PLEXUS VISCERAUX.
175 - Les différents plexus: les plexus somatiques
Les principaux plexus somatiques comprennent les plexus
- cervical, C2 à C4,
- brachial, C5 à D1,
- lombaire, L2 à L4,
- lombo-sacré, L4 à S5.
Le plexus brachial donne principalement naissance aux nerfs radial, médian et cubital ou ulnaire.
Le plexus lombaire donne principalement naissance au nerf fémoral.
Le plexus lombo-sacré donne principalement naissance au nerf sciatique.
Il existe, par ailleurs, un très grand nombre de nerfs tributaires de ces plexus dont nous ne parlerons pas dans le présent texte.
176 - Le plexus cervical et ses dermatomes
Le plexus cervical reçoit, par les racines C2 à C4, les fibres en provenance des dermatomes s'étalant de C2 à C4.
Des douleurs dont l'étendue ne correspond pas à l'entièreté des dermatomes décrits sont souvent observées et peuvent survenir, par exemple, à la suite de chirurgies O.R.L. oncologiques.
177 - Le plexus brachial et ses dermatomes
Le plexus brachial reçoit, par les racines C5 à D1, les fibres en provenance des dermatomes s'étalant de C5 à D1.
Des douleurs dont l'étendue ne correspond pas à l'entièreté des dermatomes décrits peuvent survenir en présence de plexopathie brachiale.
178 - Le plexus lombaire et ses dermatomes
Le plexus lombaire reçoit, par les racines L2 à L4, les fibres en provenance des dermatomes s'étalant de L2 à L4.
Là encore, des douleurs dont l'étendue ne correspond pas à l'entièreté des dermatomes décrits peuvent survenir en présence de plexopathie lombaire.
179 - Le plexus lombo-sacré et ses dermatomes
Le plexus lombo-sacré reçoit, par les racines L4 à S5, les fibres en provenance des dermatomes s'étalant de L4 à S5.
En présence d'une atteinte lombo-sacrée, la distribution des douleurs peut, à première vue, paraître déroutante. On peut ainsi observer un syndrome douloureux comportant une douleur péri-anale gauche (S3) et une douleur au talon gauche (S1).
Il faut se rappeler qu'une des particularités des douleurs neurogènes par plexopathie néoplasique est de présenter un tableau de douleurs éparses ne respectant pas totalement l'ensemble de chacun des dermatomes. Cette distribution est pourtant logique, même si l'examen neurologique ne permet pas de dépister d'anomalie motrice. En effet, on doit se rappeler que l'atteinte motrice peut mettre plusieurs mois à se manifester.
180 - Les différents plexus: les plexus viscéraux
Les principaux plexus viscéraux comprennent les plexus
- coeliaque,
- mésentérique supérieur,
- mésentérique inférieur,
- hypogastrique,
- pelvien ou pré-sacré.
181 - Les plexus viscéraux et leurs afférences nociceptives
-
Le plexus coeliaque reçoit ses afférences nociceptives de l'estomac, du grêle, du caecum, de l'appendice, du colon ascendant et transverse aussi bien que du colon descendant, du sigmoïde, du rectum, du foie, de la vésicule biliaire, des canaux biliaires, du pancréas et des surrénales.
Il reçoit aussi une part d'afférences nociceptives des reins, des uretères, des testicules, des canaux déférents, des ovaires et des trompes.
Le plexus mésentérique supérieur reçoit ses afférences nociceptives principalement du colon transverse.
Le plexus mésentérique inférieur reçoit ses afférences nociceptives principalement du colon descendant, du sigmoïde et du rectum.
Le plexus hypogastrique reçoit ses afférences nociceptives du colon descendant, du sigmoïde et du rectum, de la vessie, de la prostate, des vésicules séminales, de l'urètre, des testicules, de l'utérus, des ovaires et du dôme vaginal.
Le plexus pré-sacré ou pelvien reçoit ses afférences nociceptives du colon descendant, du sigmoïde et du rectum, de la vessie, de la prostate, des vésicules séminales, de l'urètre, de l'utérus et des organes génitaux externes.
182 - La proximité du plexus somatique lombo-sacré et du plexus viscéral pré-sacré
La représentation anatomique du plexus pré-sacré ou pelvien permet de particulièrement bien illustrer l'extrême proximité du plexus somatique lombo-sacré et du plexus viscéral pré-sacré. On comprend alors plus facilement les ravages que des masses néoplasiques peuvent entraîner quand elles se développent dans le petit bassin, à proximité de ces plexus.
Plusieurs types de cancers peuvent être mis en cause dans cette région, notamment les cancers de la prostate, de la vessie, du col utérin, de l'utérus et du rectum sans compter les métastases d'un cancer du sein ou du poumon.
Ainsi, lorsqu'une tumeur se développe dans le petit bassin, il peut être possible d'observer un tableau composé des signes et symptômes suivants:
- des douleurs au périnée, uni ou bilatérales,
- des douleurs dans une ou dans les deux jambes,
- des parésies variables touchant divers groupes musculaires dans une ou dans les deux jambes,
- une incontinence urinaire.
Une telle distribution de signes et de symptômes est possible parce que les masses néoplasiques s'étendent de façon anarchique et souvent extensive vers toutes les structures du petit bassin. L'espace étant relativement étroit, il est ainsi facile d'envahir le plexus somatique lombo-sacré et le plexus viscéral pré-sacré pour donner un tableau clinique d'une relative complexité, à première vue.
183 - Les radiculopathies et la double intrigue
Une telle présentation clinique pourrait tout aussi bien résulter non pas d'un envahissement du petit bassin touchant le plexus somatique lombo-sacré et le plexus viscéral pré-sacré mais d'une extension néoplasique para-rachidienne (ou para-vertébrale) envahissant le pourtour des racines nerveuses. La douleur neurogène par radiculopathie peut ainsi offrir un tableau clinique ressemblant à une plexopathie. L'envahissement néoplasique périradiculaire soulève cependant une double intrigue lors du diagnostic.
184 - Radiculopathies et la double intrigue: la première intrigue
La première intrigue concerne la possibilité d'une monoradiculopathie ou d'une polyradiculopathie.
Pourquoi cette question ?
Parce qu'il existe de nombreux chevauchements des afférences sensorielles dans chaque racine. Ainsi par exemple, le dermatome L5 envoie des afférences par L4, L5 et S1. Il ne faut pas confondre cette donnée anatomique d'un dermatome qui envoie ses afférences par sa racine préférentielle en utilisant en plus la racine qui lui est supérieure et inférieure avec le multiétagement faisant transit par le faisceau de Lissauer et qui prend place à l'intérieur de la moelle i.e bien après que les fibres aient fait leur entrée par les différentes racines.
Encore là, une bonne connaissance de la disposition des dermatomes vient aider grandement à situer le diagnostic. Là n'est pas la plus grande intrigue cependant. Une plus complexe reste à dénouer.
185 - Radiculopathies et la double intrigue: la seconde intrigue
La seconde intrigue, dans le cas d'une radiculopathie par atteinte néoplasique, peu importe qu'il s'agisse d'une mono ou poly radiculopathie, consiste à déterminer si l'envahissement se situe à l'extérieur du canal rachidien, c'est-à-dire en para-rachidien ou para-vertébral ou à l'intérieur de ce canal.
Dans les deux cas, la présentation clinique sera la même. Cependant, les conséquences, à court ou à moyen terme, risquent d'être considérablement différentes. La présence de tissu néoplasique dans le canal médullaire risque d'entraîner rapidement une compression médullaire dont les conséquences motrices s'ajouteront aux douleurs lorsque l'envahissement se produit en-dessus du cône médullaire (étage médullaire L1 inférieure - L2 supérieure)
ou risquent d'entraîner une compression de la queue de cheval, lorsque l'envahissement se produit en-dessous du cône médullaire.
Préciser la localisation, à l'intérieur ou à l'extérieur du canal rachidien devient d'une importance capitale. Plus de 60 % des patients atteints de cancer et qui présentent en même temps:
- une douleur rachidienne,
-
des radiographies anormales de la colonne
et - un examen neurologique normal
ont pourtant un envahissement épidural à la tomographie axiale ou à la résonance magnétique, selon les études. Cet envahissement risque de mener à brève échéance à des complications majeures motrices et sensorielles si non reconnu. Par ailleurs, cet envahissement fait partie des urgences radio-oncologiques absolues.
186 - Douleurs neurogènes: souvent une superposition de plusieurs différentes douleurs
En raison des différents mécanismes pathophysiologiques élaborés plus avant, les douleurs neurogènes se présentent souvent comme une superposition de plusieurs types de douleurs.
Ainsi, qu'il s'agisse d'une plexopathie avec atteinte plexonale multifocale, d'une monoradiculopathie ou d'une polyradiculopathie, que l'agression sur le tissu nerveux provienne d'une compression causé par l'oedème péritumoral ou par la masse tumorale elle-même, que cette agression associe compression et infiltration ou encore l'ensemble de la séquence compression-infiltration-sectionnement (Voir: DOULEUR NEUROGENE ET MASSE TUMORALE: LA SEQUENCE COMPRESSION - INFILTRATION - SECTIONNEMENT) ou que cette agression découle d'un autre contexte que le présence de cellules tumorales au pourtour du tissu nerveux, la résultante est souvent celle d'une présentation clinique où plusieurs types de douleurs se superposent. Or, cette superposition de douleurs différentes est très souvent ignorée par la personne qui a mal.
C'est l'application d'une thérapeutique adéquate qui rendra évident cet état de fait qui se révélera à l'occasion comme une surprise décevante puisqu'en traitant la douleur dans une région donnée, il sera possible d'observer à l'occasion l'apparition
-
d'une autre sorte de douleur dans la même région
et même - d'une nouvelle douleur dans une nouvelle région.
Il faudra alors savoir discerner et surtour reconnaître, par une évaluation "éclairée" basée sur de bonnes connaissances physiopathologiques, la ou les différences entre les douleurs "antérieures au traitement" et les "nouvelles" douleurs ressenties depuis l'application de la thérapeutique adéquate. Les douleurs dites "nouvelles" à l'évaluation seront nécessairement différentes des douleurs "antérieures au traitement", elles étaient déjà présentes auparavant mais "cachées" par les premières qui étaient plus intenses, plus dérangeantes. Tout se déroule comme si le cerveau ne savait ou ne pouvait interpréter toutes les sortes de douleurs en même temps. De là vient peut-être cette impression décevante qu'à une douleur "réglée ou atténuée" succède une autre douleur.
187 - Douleurs neurogènes: les surprises d'un traitement adéquat !
Ainsi, en traitant adéquatement la douleur dans une région donnée, il n'est pas rare d'observer l'apparition
-
d'une autre sorte de douleur dans la même région
et même - d'une nouvelle douleur dans une nouvelle région.
188 - Douleurs neurogènes: un jeu d'ombrages superposés
Les discussions autour de la classification des différentes douleurs offerte plus avant ont permis d'exposer différents mécanismes pathophysiologiques par lesquels la douleur peut se manifester. Tous sont associés à une agression sur le réseau nociceptif. Ainsi, certains processus reposent sur une activation de nocicepteurs par des substances algogènes (Voir: LE CARACTERE "AGRESSANT" DES DIFFERENTS STIMULI "DOULOUREUX" ET LA PRODUCTION DE SUBSTANCES INFLAMMATOIRES / L'ACTIVATION "PRIMAIRE" / L'ACTIVATION "PRIMAIRE": ACTIVATION ET SENSIBILISATION DES NOCICEPTEURS / L'ACTIVATION "SECONDAIRE") alors que d'autres processus découlent d'une portion ou de l'ensemble de la séquence compression-infiltration-sectionnement (Voir: DOULEUR NEUROGENE ET MASSE TUMORALE: LA SEQUENCE COMPRESSION - INFILTRATION - SECTIONNEMENT) ou encore d'un autre contexte que le présence de cellules tumorales au pourtour du tissu nerveux.
A titre d'exemple, une même personne peut donc se trouver porteuse des différentes douleurs suivantes:
- douleurs osseuses par métastases osseuses en différents sites dont certaines côtes, l'humérus droit, la région lombaire basse et le fémur gauche,
- hépatalgie par métastases hépatiques causant une hépatomégalie,
- douleurs neurogènes simples au bras gauche par compression du plexus brachial,
- douleurs accompagnées au bras gauche par envahissement du même plexus,
- douleurs paroxystiques toujours au bras gauche pour la même raison.
En fait, que les douleurs soient provoquées par un envahissement osseux métastatique, par un étirement de capsule, qu'elles proviennent d'une plexopathie avec atteinte plexonale multifocale, d'une monoradiculopathie ou d'une polyradiculopathie, elles se présentent dans leur ensemble comme une superposition de plusieurs types de douleurs.
C'est ainsi que la douleur peut être comparée à un jeu d'ombrages superposés.
Pour illustrer ce concept d'ombrages superposés, supposons trois personnes de taille différente alignées en ordre décroissant de grandeur de sorte que la première cache la deuxième qui cache à son tour la troisième et un observateur placé à une certaine distance devant la plus grande de trois personnes. Il sera impossible à l'observateur de voir les deux personnes de plus petite taille placées derrière la personne la plus grande tant et aussi longtemps que la plus personne de plus grande taille maintiendra sa position. Ce n'est que lorsque la plus grande des trois personnes se sera déplacée que l'observateur pourra voir apparaître la personne de taille moyenne qui cachera encore celle de plus petite taille et ce n'est que lorsque la personne de taille moyenne se sera enfin déplacée que celle de plus petite taille apparaîtra enfin.
Il en va de même pour les douleurs qui peuvent se superposer dans une région donnée. La douleur la plus intense masque les autres et ce n'est qu'en la traitant avec un choix thérapeutique approprié que les autres douleurs peuvent se manifester, celles-ci provenant de mécanismes pathophysiologiques différents de ceux déjà traités. Ainsi, le fait d'éteindre ou d'atténuer le mécanisme dominant permet aux autres mécanismes pathophysiologiques de s'exprimer.
Il est même possible d'extensionner ce concept à des douleurs localisées en des endroits différents et n'ayant aucun lien pathophysiologique avec la douleur dominante la plus intense. Ce n'est qu'après avoir traité adéquatement cette douleur la plus intense, celle qui occupe toute la place, que d'autres douleurs, siégeant ailleurs, seront ressenties. Auparavant ces douleurs étaient présentes mais ignorées parce que les douleurs les plus intenses prenaient toute la place.
En fait, tel que suggéré plus avant, la raison de ces "nouvelles" douleurs qui semblent s'être révélées après un traitement analgésique "efficace" trouve probablement une partie de son explication dans les zones d'interprétation et de conscientisation des douleurs au niveau du cerveau. Le cerveau ne saurait ou ne pourrait interpréter toutes les sortes de douleurs en même temps. Il faut avoir été parent de plusieurs adolescents pour comprendre que le cerveau ne peut traiter toutes les informations en même temps!!!
189 - Les composantes non-physiques
Nous n'avons discuté, jusqu'à maintenant, que des bases pathophysiologiques des douleurs organiques et que des circuits "électroniques" sur lesquels ces mêmes douleurs reposent. Il existe pourtant un autre visage aux douleurs en contrepartie des composantes physiques: le volet des douleurs non-physiques ou encore le volet non-physique des douleurs ou encore mieux dit la douleur globale ou douleur totale.
C'est à l'ouverture vers le monde des émotions et à l'intégration des différentes composantes de ce monde avec les douleurs physiques que cette dernière portion du premier manuel sur les différentes sortes de douleurs s'attarde.
Un effort sera fait pour rattacher le volet affectif ou émotionnel, avec ses composantes psycho-socio-spirituelles classiques, à un substrat anatomique et physiologique. Ceci peut ainsi permettre d'illustrer la justesse de la vision analytique, connue depuis longtemps, reliant les nombreux phénomènes physiques et non-physiques, vécus à l'intérieur d'une même personne, et qui sont mis en branle dans le processus des douleurs qui se prolongent.
La résultante de l'intégration de deux volets affectifs ou émotionnels avec les substrats anatomiques et physiologiques doit être comprise comme une entité différente des douleurs dites "psychogènes" qui elles, ne possèdent pas de substrat anatomo-physiologique comme point de départ alors que les douleurs non-physiques ont débuté avec des substrats anatomo-physiologiques véritables.
190 - Les composantes non-physiques: leur substrat anatomo-physiologique
C'est tout l'ensemble des circuits complexes et hautement intégrés comprenant
-
le faisceau paléo-spinothalamique mais aussi les faisceaux
- spino-réticulaires
- spino-mésencéphaliques
- les autres faisceaux qui leur sont reliés (spino-solitaires et autres)
qui nous offre un tel renforcement anatomo-physiologique du concept de douleur globale ou douleur totale. En fait, on attribue à ces circuits, la fonction de véhiculer, les influx nociceptifs dans les régions du cerveau gérant la composante affective de la douleur. (Voir: LE POINT D'ARRIVEE DES INFLUX NOCICEPTIFS: LES ETAGES SUPERIEURS "MODE SENSORIEL" ET "MODE AFFECTIF")
De toute évidence, le concept de douleur globale ou douleur totale en soi n'a pas besoin d'un tel renforcement. Pourtant, il est étonnant de constater comment ces très vieux circuits peuvent jouer le rôle de substratum physique au concept de "douleur globale ou totale".
En fait, le faisceau paléo-spinothalamique et les autres (spino-réticulaires, spino-mésencéphaliques, spino-solitaires) ont traversé toutes les étapes nécessaires de l'évolution des espèces, pour arriver au modèle de l'homo sapiens sapiens . Ces circuits intégrés, formés des vieilles fibres C, représentent un des héritages les plus anciens des différents circuits nerveux véhiculant les messages nociceptifs depuis nos ancêtres les poissons. Ces circuits, comme le cerveau et l'ensemble du système nerveux central, ont continué d'évoluer à travers le temps et ont connu des adaptations nombreuses et variées avant d'en arriver à l'extrême complexité que nous leur connaissons aujourd'hui.
Pendant cette évolution, les fibres du réseau paléo-spinothalamique et des autres réseaux nociceptifs se sont interconnectées avec de multiples régions ou structures du cerveau, chacune de ces régions ou structures exerçant une fonction bien précise. Parmi ces régions ou structures, on peut mentionner:
- le système limbique, responsable de nos humeurs et de nos émotions;
- le cortex frontal, responsable de nos normes comportementales en société;
- la formation réticulée, responsable des mécanismes de vigilance et de la régulation du cycle d'éveil-sommeil ainsi que des circuits réglant nos fonctions vitales comme la respiration et même ceux intimement liée au contrôle "autonomique" ou involontaire de nos viscères.
Le faisceau paléo-spinothalamique est encore relié à de nombreuses autres structures. La pertinence d'en discuter plus longuement dépasse cependant le cadre de ce manuel.
Il va sans dire que, lors de stimulations douloureuses, toutes et chacune des régions et structures reliées aux faisceaux paléo-spinothalamiques et autres faisceaux nociceptifs (Voir: LE SYSTEME DE TRANSPORT DES INFLUX NOCICEPTIFS: LA PORTION CENTRALE D'ORIGINE MEDULLAIRE) deviennent "inondées" d'influx nociceptifs. Ces influx nociceptifs arrivent au cerveau, à partir de la zone douloureuse, partout et en même temps dans toutes les structures impliquées. Ce n'est qu'après cette "intense inondation" que débutent les complexes processus tels les nombreux relais de l'information, les jeux de rétroaction et de mobilisation des circuits activateurs et inhibiteurs dans les nombreuses régions cérébrales et médullaires impliquées qualifiés dans leur ensemble de mécanismes modulateurs.
Le cortex pariétal, chargé d'interpréter finalement les influx douloureux en provenance des faisceaux nociceptifs médullaires et des différentes structures cérébrales impliquées, intègre ces informations pour les traduire en perception de la douleur. Deux régions du cortex pariétal (S1 et S2) apparaissent comme étant les principaux centres corticaux impliqués dans la réception et la perception des stimuli douloureux. (Voir: LE SYSTEME DE TRANSPORT DES INFLUX NOCICEPTIFS: LA PORTION CENTRALE D'ORIGINE MEDULLAIRE / LE POINT D'ARRIVEE DES INFLUX NOCICEPTIFS: LES ETAGES SUPERIEURS "MODE SENSORIEL" ET "MODE AFFECTIF")
De tels processus, plus complexes les uns que les autres, permettent finalement que l'ensemble des informations physiques et psychoaffectives soient intégrées les unes aux autres, dans chaque personne qui souffre.
Mais le processus ne s'arrête pas là.
191 - Maladie plus douleurs: trois groupes cibles
Dès le moment du diagnostic ... (de cancer), la maladie et les douleurs qui accompagnent très souvent le cancer de façon très précoce entraînent, elles aussi, leurs fardeaux de réactions et de charges émotives.
En fait, qu'on en soit au moment du diagnostic, durant la phase de traitement et la phase de rémission tant espérée, durant la phase palliative, lors de la phase terminale ou pendant les derniers jours de vie, on peut concevoir que ces différentes phases ou étapes constituent une rude épreuve
- pour la personne atteinte,
- pour sa famille ou son entourage immédiat,
- aussi bien que pour les ressources soignantes.
Il n'est pas abusif de concevoir, pendant ces périodes, que le monde des émotions soit considérablement secoué et mis à l'épreuve pour tous et chacun.
192 - Maladie plus douleurs: des impacts chez la personne atteinte
Du diagnostic à la phase terminale, des maladies telles le cancer, le SIDA ou d'autres maladies à haut potentiel de débilitation de même que les douleurs qui accompagnent ces dites maladies, entraînent chez la personne atteinte des impacts multiples. Aucun doute n'est permis à cet effet.
193 - Les douleurs: place centrale chez la personne atteinte
Du diagnostic à la phase terminale, la douleur, malheureusement, occupe souvent une place centrale chez la personne atteinte.
194 - Maladie plus douleurs: des impacts physiques et non-physiques
Ces impacts sont non seulement multiples, mais ils touchent toujours les deux dimensions de la vie: la dimension physique et la dimension non-physique.
Chaque humain étant intégralement composé de ces deux dimensions, voilà un excellent aperçu de ce que le concept de globalité sous-entend.
195 - Les impacts physiques: les différents systèmes
Du diagnostic à la phase terminale, les impacts physiques peuvent se faire sentir sur les systèmes suivants:
- nerveux,
- oto-rhino-laryngologique,
- cardiovasculaire,
- endocrinien,
- urologique,
- locomoteur,
- dermatologique,
- pulmonaire,
- digestif
- reproducteur.
En fait, ces impacts sont ressentis, d'une façon ou d'une autre, à travers les nombreux symptômes physiques d'inconfort témoignant d'une atteinte organique (nausées, détresse respiratoire, écoulements malodorants, fistules entéro-cutanées etc.).
S'il n'y avait que la douleur, les turbulences dans le monde des émotions seraient déjà énormes. La présence d'un ou plusieurs symptômes physiques accompagnant, s'ajoutant ou "rappelant" cette affreuse maladie qu'est le cancer vient alors grandement accentuer toutes les perturbations déjà vécues sur le plan psychoaffectif.
196 - Les impacts non-physiques: les différentes sphères de vie
Du diagnostic à la phase terminale, les impacts non-physiques, ce sont les impacts qui peuvent être ressentis par la personne atteinte dans une ou plusieurs sphères de sa vie.
Les impacts non-physiques peuvent ainsi toucher les domaines de la vie:
- personnelle,
- conjugale,
- familiale,
- professionnelle,
- économique,
- sociale,
- spirituelle
- ethno-culturelle.
197 - Maladie plus douleurs: des impacts chez la famille
Tout comme si ces impacts personnels ne suffisaient pas, on se doit d'ajouter les impacts familiaux. En effet, la maladie n'a pas de répercussions uniquement que sur la personne atteinte, elle affecte également la famille.
Ces impacts, par un retour malheureux, viennent encore ajouter au fardeau des impacts physiques et non-physiques provoqués par la maladie chez la personne atteinte. Car il faut bien le voir ainsi, les bouleversements provoqués par la maladie sur la famille sont susceptibles d'entraîner, à leur tour, des impacts chez la personne malade qui en subissait déjà un certain nombre en rapport direct avec sa maladie.
198 - Les impacts familiaux: trois sous-groupes cibles
Les impacts familiaux, ce sont à leur tour les impacts qui sont ressentis chez
- le conjoint ou la conjointe,
- la famille immédiate, c'est-à-dire les enfants,
- la famille proche, c'est -à-dire les parents directs de la personne atteinte et la fratrie (père, mère, frères et soeurs),
- la parenté plus éloignée c'est-à-dire les oncles, tantes, cousins, etc.
Ces impacts peuvent se manifester de façons extrêmement diverses chez tous et chacun des membres de la famille.
199 - Maladie plus douleurs et les impacts multiples: un premier exemple
Les deux exemples qui suivent permettent d'illustrer chacun de ces aspects.
Premier exemple
Une femme de 38 ans, atteinte d'un cancer du sein depuis l'âge de 27 ans, mariée et mère de deux adolescents, a présenté jusqu'à maintenant deux récidives qui ont, chaque fois, bien répondu à la chimiothérapie offerte, avec de longues périodes de rémission.
Depuis quelques mois, elle présente une troisième récidive qui, cette fois, n'a pas répondu totalement à l'essai de deux différents protocoles de chimiothérapie. Les réponses, toutefois, sont assez bonnes et le tableau tumoral ne semble pas en progression ces derniers mois.
Il est possible et même probable que le changement de cap dans l'évolution de sa maladie lui amène de nombreux impacts dans plusieurs domaines de sa vie.
Ainsi, elle est maintenant beaucoup plus préoccupée, inquiète, tendue. Toute sa vie personnelle s'en ressent, mais aussi sa vie conjugale et familiale.
Le mari quant à lui a recommencé à boire et un des deux adolescents a vu ses notes scolaires dégringoler et il a commencé à ne pas se présenter au domicile familial certains soirs et ce au grand désarroi des parents.
Cette personne avait une implication sociale immensément gratifiante pour elle, elle était responsable d'un groupe de jeunes au niveau du mouvement Scout et Janette de sa petite ville. Ces activités lui avaient toujours procuré beaucoup de plaisir. Or, l'évolution de son cancer depuis les derniers mois l'a empêchée de participer à cette activité et son groupe lui manque beaucoup. Elle en est grandement chagrinée.
Elle avait toujours été une bonne croyante, mais elle vit maintenant une certaine révolte intérieure vis-à-vis son Dieu qu'elle trouve injuste. Or elle se trouve incapable de témoigner ouvertement de cette révolte, elle qui est considérée comme tellement courageuse et tellement bonne croyante par son entourage.
200 - Maladie plus douleurs et les impacts multiples: un deuxième exemple
Deuxième exemple
Un homme de 44 ans, marié, père de deux enfants encore à la maison assume, à lui seul, le gagne-pain de la famille. Il a immigré au pays il y a 2 1/2 ans et a dû attendre 1 1/2 an avant de faire venir son épouse et ses enfants. Son épouse se débrouille à peine en français et en anglais.
Au cours de la dernière année, il a présenté une baisse de son état de santé et un diagnostic de cancer du poumon a été établi il y a deux mois. Le cancer n'était pas opérable au moment du diagnostic.
Il vit le diagnostic avec beaucoup de bouleversements émotifs et vit en même temps son atteinte systémique avec une certaine colère. Son épouse dit qu'il n'est plus reconnaissable.
Il appréciait son emploi mais l'emploi qu'il occupait ne lui assure pas un régime adéquat de couverture d'assurance.
Au cours des derniers mois il a dû ralentir beaucoup ses activités de travail et les entrées d'argent sont de moins en moins importantes. Il se fait beaucoup de souci à cause de cette réduction du revenu disponible pour les dépenses familiales et se culpabilise pour cette situation qu'il n'accepte pas.
Son patron, devenu de plus en plus intolérant face à ses absences répétées, exige une présence à plein temps ou rien du tout, tellement la productivité de sa petite entreprise se trouve affectée par ses absences répétées.
Le patient devra bientôt quitter son emploi, la rage au coeur.
Peu de personnes de son pays vivent dans la ville où il habite et il se sent relativement isolé et seul dans ce qu'il vit en n'ayant personne d'autre que son épouse à qui il pourrait dire dans sa langue comment il a mal et comment il souffre.
Ces deux exemples ne sont pas tirés de téléromans. Ils sont le reflet des mille et une facettes d'horreur que le cancer impose aux personnes atteintes. De tels exemples pourraient tout aussi bien être vécus avec un diagnostic de SIDA.
201 - La douleur chronique: un cercle très vicieux!
En somme, ces différents impacts vécus par voie directe ou indirecte entraînent de profonds courants de turbulence dans tout le réseau gérant l'intégration de la vie affective et comportementale.
Les conséquences en sont multiples à commencer souvent par un dérèglement du cycle d'éveil et de sommeil. Il en va ainsi pour ce qui est du seuil de la douleur qui, en présence de turbulences émotionnelles, s'abaisse considérablement, facilitant ainsi la perception des douleurs physiques beaucoup plus précocement.
La personne qui avait déjà mal connaît ainsi une accentuation de ses douleurs, même de faibles stimuli douloureux sont mal reçus dans un cerveau troublés, préoccupés, peinés, en manque de sommeil réparateur. Et pourtant, les influx nociceptifs en provenance des faisceaux paléo-spinothalamiques et autres faisceaux nociceptifs continuent d'envahir, d'inonder toutes les zones impliquées dans la perception et la gestion des influx douloureux.
En peu de temps, la douleur, de purement physique qu'elle était au début, sera ressentie comme une douleur dans le corps, doublée de multiples inconforts dans l'être.
La maladie aura pour ainsi dire recouru à un néfaste allié, la douleur, pour entraîner une cascade de bouleversements qui, bien souvent, emprisonne la personne dans le cercle vicieux de la douleur chronique.
L'ensemble de ces impacts, surajouté à une ou des douleurs présentes, entraîne une atténuation de la quantité et de la qualité du sommeil.
Les différents impacts tant physiques que non-physiques, surajoutés l'un à l'autre, éveillent, chez la personne qui a mal, de vieux sentiments qui ont accompagné la nature humaine depuis ses origines.
La fatigue s'installant, les vieux sentiments surgissent:
- l'angoisse,
- la détresse,
- le désespoir,
avec comme conséquence un isolement social de plus en plus grand.
En même temps, apparaît une réduction de la capacité d'éprouver du plaisir tellement la ou les douleurs sont omniprésentes, dérangeantes et totalement envahissantes.
Toutes ces turbulences confondues entraînent un abaissement encore plus important du seuil de la douleur et la personne s'enfonce progressivement dans un gouffre, prisonnière qu'elle est d'un cercle vicieux qui ne fait que s'accentuer jour après jour.
202 - La douleur globale ou douleur totale ou la souffrance: un mal redoutable
Décidément, la douleur globale ou douleur totale ou la souffrance "tout court" est un mal redoutable à éprouver.
Il sera particulièrement important, comme nous le verrons dans le manuel II portant sur l'évaluation de la ou des douleurs, d'en identifier toutes les composantes, sans quoi toute gestion analgésique risque de devenir, en partie, vide de sens, n'apportant alors qu'une portion des bénéfices qu'elle aurait dû produire.
203 - Fin
FIN DU MANUEL I