Le diagnostic
La Direction générale de cancérologie du Québec a publié en 2017 des Outils de détection des cancers par le médecin de famille qui proposent des délais sécuritaires de référence des patients avec un cancer possible.
La littérature médicale actuelle supporte le fait qu’un diagnostic précoce de cancer améliorerait la survie des patients. Même si les preuves robustes existent pour certains cancers, on se base en clinique sur des consensus d’experts quant aux délais d'investigation et de traitement à respecter, d’autant plus que pour des raisons éthiques évidentes peu d’essais cliniques se penchent sur l’impact sur la survie du retard de traitement.
Ces experts appliquent aux traitements chirurgicaux des données disponibles surtout sur les traitements non chirurgicaux. À la lumière de ces informations, il est permis d’affirmer que les délais d’investigation et donc de traitements pourraient avoir un effet défavorable sur le stade du cancer au moment de son diagnostic, sur les résultats des traitements apportés ainsi que la détresse du patient et de ses proches devants des délais prolongés sans compter les coûts supplémentaires associés possiblement à un diagnostic plus tardif Avis sur les délais dans le traitement chirurgical du cancer – Conseil québécois de lutte contre le cancer – 2001.
Le Conseil québécois de lutte contre le cancer s’est donc prononcé sur des délais qu’il juge acceptables, délai entre un diagnostic présumé et un traitement chirurgical à visée curative : tout comme le National Health Service anglais, le délai moyen médicalement acceptable serait de 4 semaines, modulé entre autres par l’évolution naturelle de chaque cancer, certains étant plus agressifs que d’autres Avis sur les délais dans le traitement chirurgical du cancer – Conseil québécois de lutte contre le cancer – 2001.
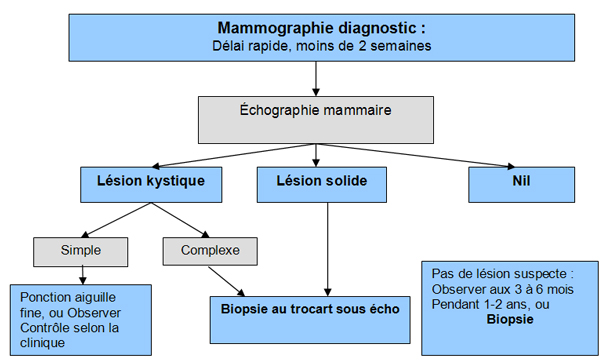
Toute masse unique nouvelle au sein ou modification suspecte de la consistance du tissu mammaire mérite des examens complémentaires Schéma 2. Pour les femmes qui se présentent avec sensation ou une douleur nouvelle, unilatérale au sein, il est suggéré de procéder comme pour une masse au sein, même si le risque de cancer n’est que de 1,2 à 6,7 % dans ces cas 1.
La mammographie est essentiellement un examen de dépistage, mais elle possède une certaine utilité dans le processus diagnostic. On ne devrait pas s’y fier dans le cas de l’apparition d’une masse nouvelle au sein lorsque le résultat est normal. En effet, la sensibilité et la spécificité de la mammographie pour un nodule palpable ne sont que de 87,3 % et 84,5 % respectivement 2. La mammographie ne détecte pas 10 à 20 % des cancers palpables 3.
Même si elle sous-estime habituellement la taille réelle de la tumeur, la mammographie bilatérale est importante pour compléter l’évaluation d’un cancer du sein Annexe 6 - Classification des cancers . Elle peut identifier plusieurs sites suspects de cancer, donc détecter un cancer multifocal (dans un quadrant) ou multicentrique (plusieurs quadrants) ou même, dans certains cas, un cancer du sein bilatéral. Le site américain d’oncologie NCCN détaille les recommandations américaines quant au diagnostic du cancer du sein 4.
Schéma 2 -
| Algorithme diagnostic simplifié pour une masse palpable au sein chez une femme de 40 ans et plus* 5 |
|
*Chez la femme de moins de 40 ans, il est quelquefois plus approprié de faire d’emblée une échographie car le sein est plus dense. |
Pour les femmes de 30 à 35 ans ou moins, la mammographie ne pourra pas différencier aisément la densité d’une glande jeune de celle d’un cancer : en fait, pour ces jeunes femmes, le fait d’avoir ou non une mammographie ne change rien à la suite de l’investigation, l’échographie étant l’examen de choix à cet âge.
On peut attendre un cycle menstruel pour voir si la lésion disparaît ou diminue de taille spontanément, signe de bénignité quas-assurée.
Sinon, on procède d'emblée chez les jeunes patientes à une échographie et une biopsie de la zone suspecte visible à l'échographie (écho-guidage). Les lésions kystiques symptomatiques ou complexes à l’échographie sont référées pour une biopsie d’aspiration : si le liquide est sérosanguinolent, on procède à la biopsie car le risque de cancer est augmenté.
Pour les milieux où cette modalité est accessible, on pourra effectuer une résonance magnétique avec rehaussement par un produit de contraste (gadolinium) mais la résonance magnétique ne fait pas partie des imageries diagnostic recommandées pour la majorité des patientes: il ne faut pas retarder le diagnostic en attente de cette imagerie.
La résonance magnétique offrirait une valeur prédictive positive supérieure à la mammographie (72% versus 53%) mais elle n'est pas recommandée comme examen de dépistage 6. Presque tous les cancers invasifs du sein seraient captés par la résonance magnétique, mais cette imagerie manque de spécificité : elle capte aussi de nombreuses lésions bénignes ce qui limite actuellement son utilité en clinique 7. Lorsque disponible, on réserve actuellement cette modalité à certaines situations énumérées dans le tableau VI, dont les femmes jeunes avec une glande mammaire dense.
Tableau VI -
|
Utilité de la résonance magnétique dans le dépistage ou le diagnostic d’un cancer du sein |
| Le dépistage des femmes à haut risque (mutations génétiques) |
| L’évaluation d’un cancer du sein chez une femme avec une glande très dense, dont les jeunes femmes de 35 ans et moins |
| L’évaluation du sein affecté par un cancer, à la recherche d’un deuxième cancer synchrone |
| L’évaluation de l’autre sein chez une femme avec un diagnostic de cancer du sein à la recherche d’un deuxième cancer du sein occulte controlatéral |
L’échographie est la modalité la plus souvent utilisée comme examen complémentaire à la mammographie. Elle est capable dans la majorité des cas de faire la différence entre une lésion kystique ou solide et donc de guider la suite de l'investigation. Elle peut aussi différencier un fibroadénome d’une lésion suspecte. On a recours d’emblée à l’échographie dans les situations décrites au tableau VII.
Tableau VII -
|
Utilité de l’échographie mammaire dans le diagnostic du cancer du sein |
| Pour les femmes de 35 ans et moins |
| Pour évaluer une lésion découverte à la mammographie |
| Pour guider la biopsie à l’aiguille (écho guidage) |
| Pour mesurer la tumeur avant la chirurgie |
| Pour évaluer une masse trop petite pour subir une aspiration à l’aiguille |
Un kyste simple à l’échographie a très peu de chances d’être un cancer 8. La valeur prédictive négative de l’échographie mammaire est élevée, encore plus élevée si elle est combinée à la mammographie, de l’ordre de 97 % 9. Mais certaines publications ont démontré une variation significative entre radiologistes quant à leur capacité de différencier des lésions solides bénignes des lésions malignes, ce qui fait que l’échographie ne peut pas à elle seule suffire à exclure un cancer lorsqu’une lésion est suspecte à la mammographie ou à l’examen physique 10. Seule la biopsie peut le faire.
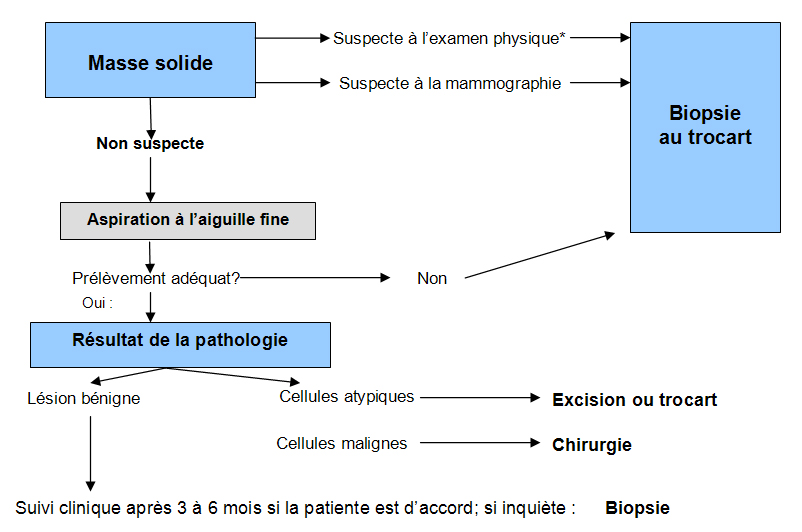
La biopsie est donc recommandée pour toute lésion suspecte, cliniquement ou à l’imagerie. On ne procède à la biopsie chirurgicale (biopsie ouverte ou excision) que si les modalités de biopsies guidées percutanées ne sont pas disponibles. Pour les patientes avec une lésion très suspecte, une échographie de l’aisselle à la recherche d’une adénopathie augmentée de volume permet de procéder d’emblée à la biopsie à l’aiguille de ce ganglion. Si cet examen révèle des cellules cancéreuses, le chirurgien procèdera d’emblée à une dissection complète de l’aisselle et non pas à simple exérèse d’un ganglion sentinelle.
Le diagnostic d’une lésion kystique complexe ou d’une masse solide au sein se fait par biopsie et aspiration de la lésion, biopsie à l’aiguille fine le plus souvent, le sein étant un organe facile d’accès. En des mains expertes, cette procédure est peu douloureuse et comporte peu de complications. On immobilise la masse entre les doigts et on aspire le liquide avec une aiguille de calibre 22 ou 24. Si le liquide retiré est clair, non sanguinolent, le risque de cancer est très faible 11. On envoie pour une analyse pathologique tout ce qui est prélevé, surtout le liquide teinté de sang : 7 % seront des cancers.
Si la ponction ne ramène pas de liquide, on tente d’obtenir des cellules pour une analyse cytologique. La sensibilité et la spécificité de l’aspiration biopsie à l’aiguille fine est très variable (65 à 98 %, 34 à 100 %) et semble dépendre surtout de l’expérience du médecin et du cytopathologiste 12. La biopsie à l’aiguille fine percutanée ne permet pas de distinguer le carcinome in situ du carcinome invasif et apporte un taux significatif de spécimens inadéquats (4 à 36 %) ou faussement négatifs (0 à 32 %) surtout en des mains inexpérimentées 13.
Certaines études démontrent que la biopsie à l’aiguille fine en des mains expertes semble presque aussi fiable qu’une biopsie au trocart pour poser un diagnostic d’un carcinome palpable au sein, avec une sensibilité de 85 à 90 % et 96 à 98 % respectivement 14 15. Le consensus actuel aie que ces deux techniques seraient comparables en termes de sensibilité, mais que la biopsie au trocart serait plus spécifique.
Le triple diagnostic Schéma 3 réfère à l’association des 3 techniques d’examen pour l’évaluation d’une masse solide au sein : l’examen physique, la mammographie et la biopsie fine à l’aiguille. Très peu de cancers sont manqués ainsi, soit 0, 7 %, lorsque ces 3 examens suggèrent une lésion bénigne et que le prélèvement est de quantité suffisante 16. Lorsqu’un de ces examens suggère un cancer, la patiente devra alors subir une biopsie au trocart ou une biopsie excisionnelle. Le Schéma 3 résume ceci. Idéalement, toute masse suspecte à l’examen physique ou à l’échographie devra subir une biopsie au trocart sous échographie ou stéréotaxie.
Schéma 3 -
|
Triple diagnostic Évaluation d’une masse solide au sein palpable et mise en évidence à l’échographie |
|
|
| * Masse de plus de 2 cm, dure, fixe, contours ou surface irréguliers, adhérence à la peau. |
La biopsie au trocart, grâce à un plus gros calibre (14 à 18), permet de prélever plus de matériel : ainsi, l’expertise du cytopathologiste n’est plus en cause pour l’interprétation. La biopsie au trocart est effectuée le plus souvent sous stéréotaxie (mammographique), surtout lorsque la lésion est profonde, proche de la paroi thoracique ou lorsqu’elle comporte du micro calcifications, ces dernières n’étant pas visibles à l’échographie.
La biopsie sous guidage échographique est utile surtout lorsque la masse n’est pas palpable : le passage de l’aiguille dans la lésion suspecte est visualisé. La biopsie au trocart permet de différencier une hyperplasie focale atypique d’un carcinome canalaire in situ ou d’une maladie invasive.
De petits implants métalliques sont quelquefois mis en place lors de la biopsie sous échographie pour permettre de bien localiser une très petite lésion ou pour définir les rebords d’une large lésion. Ils seront utiles pour les examens de contrôle ou lors d’une chirurgie.
La maladie de Paget est particulière : presque tous les cas sont associés à un carcinome in situ ou un carcinome invasif sous-jacent alors que près de la moitié des cas n’auront pas d’anomalies à la mammographie 17. L’investigation devrait donc être poursuivie.
- 1. Smith, RL, Pruthi, S, Fitzpatrick, LA. Evaluation and management of breast pain. Mayo Clin Proc 2004; 79 :353
- 2. Barlow, WE, Lehman, CD, Zheng, Y et al. Performance of diagnostic mammographiy for women with signs or symptoms of breast cancer. J Natl Cancer Inst 2002; 94 :1151
- 3. Donegan, WL; Evaluation of a palpable breast mass. N Engl J Med 1992; 327 :937
- 4. NCCN- National Comprenhensive Cancer Network : Clinical practice guidelines in oncology; Site américain d’oncologie qui offre des recommandations détaillées sur le dépistage et l’investigation du cancer du sein www.nccn.org/professionals/physician_gls/PDF/breast-screening.pdf
- 5. Department of Health- United Kingdom; Guidance NG 12; 2015 https://www.gov.uk/government/organisations/department-of-health www.nice.org.uk/guidance.ng12
- 6. Bluemke, DA, Gatsonis, CA, Chen, MH et al. Magnetic resonance imaging of the breast prior to biopsy. JAMA 2004; 292 :2735
- 7. Hulka, CA, Smith, BL, Sgroi, DC, et al. Benign and malignant breast lesions : differenciation with echo-planar MR imaging. Radiology 1995 : 197 :33
- 8. Sickles, EA, Filly, RA, Callen, PW. Benign breast lesions :Ultrasound detection and diagnosis. Radiology 1984; 151 :467
- 9. Moy, L, Slanetz, PJ, Moore, R et al. Specificity of mammography and US un the evaluation of a palpable abnormality : retrospective rewiew. Radiology 2002; 225 :176
- 10. Rahbar, G, Sie, AC, Hansen, GC et al. Benign versus malignant solid breast masses : US differentiation.Radiology 1999 : 213 :889
- 11. Ciatto, S, Cariaggi, P, Bulgaresi, P. The value of routine cytologic examination of breast cyst fluids. Acta Cytol 1987; 31 :301
- 12. Giard, RW, Hermans, J. The value of aspiration cytologic examination of the breast . Cancer 1992; 69 :2104
- 13. Pisano, ED, Fajardo, LL, Caudry, DJ et al. Fine-needle aspiration biopsy of non palpable breast lesions in a multicenter clinical trial : results from the radiologic diagnostic oncology group V. Radiology 2001; 219 :785
- 14. Antley, CM, Mooney, EE, Layfield, LJ. A comparison of accuracy rates between open biopsy, cutting-needle biopsy , and fine-needle aspiration biopsy of the breast; a 3 year experience. Breast Journal 1998; 4 : 3
- 15. Ballo, MS, Sneige, N. Can core needle biopsy replace fine-needle aspiration cytology in the diagnosis of palpable breast carcinoma. A comparative study of 124 women. Cancer 1996; 78 : 773
- 16. Layfield, LJ, Glasgow, BJ, Cramer, H. Fine-needle aspiration in the management of breast masses. Pathol Annu 1989; 24 :23
- 17. Ikeda, DM, Helvie, MA, Franks, TS et al. Paget disease of the nipple : radiologic-pathologic correlation. Radiology 1993; 189 :89